- 장바구니가 비어 있습니다
- 쇼핑 계속하기

치료를 위한 인간 중간엽 줄기 세포의 대규모 확장을 위한 필수 도구
치료용 중간엽 줄기세포의 대규모 생산에 중요한 특수 배지, 세포 공장 및 GMP 준수 단백질을 찾아보세요.

우리의 면역체계는 수많은 항체를 생성하며, 각각은 외부 세포 표면의 항원으로 알려진 특정 단백질을 식별하도록 맞춤화되었습니다. 항체가 특정 항원과 결합하면 면역체계에 신호를 보내 표적 세포를 제거합니다.
단클론항체(mAb) 이러한 천연 항체를 모방한 인공적으로 생산된 분자입니다. 암세포와 같은 원치 않는 세포를 퇴치하도록 특별히 설계된 mAbs는 표적 치료법으로 작동하여 암세포에 존재하는 특정 단백질을 찾아내고 결합합니다.
mAbs는 암세포의 특정 단백질을 인식하여 작동합니다. 각 mAb는 특정 단백질을 인식하도록 맞춤화되었으며, 다양한 mAb는 다양한 암 유형을 해결하도록 설계되었습니다. 표적 항원에 따라 이러한 mAb는 암세포를 죽이거나 성장을 막도록 설계됩니다.
mAb는 암세포에 직접 결합하여 암세포를 죽일 수 있습니다. 표적 세포에 대한 mAb 결합은 면역 효과기 세포(예: 자연 살해 세포, 단핵구, 대식세포 또는 과립구)를 모집하여 항체 의존성 세포 독성(ADCC)을 유발할 수 있습니다. 이는 또한 보체 의존성 세포독성(CDC)을 통해 세포 사멸을 촉진할 수 있으며, 여기서 mAb가 표적 세포에 결합하면 보체 캐스케이드가 활성화되어 세포 표면에 막 공격 복합체가 형성됩니다.
하나의 예입니다 리툭, 림프종 또는 백혈병 치료를 위한 mAb. 리툭시맙은 B 세포 표면에서 발견되는 단백질 CD20을 표적으로 삼습니다. 리툭시맙이 CD20에 결합하면 ADCC, CMC 및 백혈병 세포의 직접적인 세포사멸을 유발합니다.
mAb는 암세포 생존에 중요한 필수 활성화 리간드의 결합을 방지하여 표적 세포에 직접적인 영향을 미칠 수 있습니다. 또한 수용체 이합체화를 방해하여 활성화 신호를 억제할 수도 있습니다. 더욱이, 수용체를 가교시킴으로써 이들 항체는 세포사멸 신호를 개시할 수 있습니다. 특히, mAb는 다음과 같습니다. 트라 스투 주맙 및 페르 투 주맙 이 접근법의 예를 들어보세요. 둘 다 특정 암세포에 풍부한 HER2 단백질 수용체를 특이적으로 표적으로 삼습니다. 이러한 mAb는 HER2에 결합함으로써 HER2 양성 암세포의 성장과 증식을 효과적으로 차단합니다.
mAb는 종양이 성장하기 위해 의존하는 중요한 과정인 혈관신생의 억제제 역할을 할 수 있습니다. 종양 발달에는 암이 생성하는 혈관 내피 성장 인자(VEGF)와 같은 혈관 신생 인자에 의해 추진되는 과정인 새로운 혈관의 형성이 필요합니다. 베바 시주 맙VEGF에 대응하도록 설계된 특정 mAb인 는 이러한 혈관 신생 과정을 효과적으로 중단시킵니다. 그렇게 함으로써, 진행 중인 종양에서 새로 형성된 혈관에서 공급되는 필수 영양소와 산소를 빼앗아 궁극적으로 종양의 성장을 지연시킵니다.
mAb는 면역 체크포인트 차단 메커니즘을 표적으로 삼아 T 세포 반응을 변형하고 항종양 T 세포 반응을 증폭시킬 수 있습니다. 이러한 mAb는 T 세포 표면에 존재하는 면역 체크포인트 수용체에 초점을 맞춰 일반적으로 T 세포 활성화를 억제하는 신호를 방해합니다. 결과적으로, 이들은 T 세포의 활성화 상태를 강화하여 T 세포에 의한 종양 세포 파괴를 강화합니다. 대표적인 예시는 이필 리무 맙, 흑색종 치료를 위해 설계된 FDA 승인 mAb입니다. 이필리무맙은 활성화된 T 세포에서 발견되는 체크포인트 수용체인 세포독성 T 림프구 관련 항원 4(CTLA4)를 특이적으로 억제합니다. CTLA-4를 차단함으로써 이필리무맙은 흑색종 세포에 대한 면역체계의 반응을 증가시킵니다.
특정 mAb는 방사성 화합물이나 강력한 약물과 같은 세포독성 물질을 암세포에 전달하고 건강한 세포는 살리기 위한 운반체 역할을 하도록 맞춤화될 수 있습니다. 예를 들어, 이브리투모맙 티욱세탄림프종 치료를 위한 FDA 승인 방사면역요법은 B 세포의 CD20 항원에 결합합니다. 이러한 연결은 mAB에 접합된 이트륨-90 방사성 동위원소가 베타 입자 방출을 통해 세포를 소멸시키는 것을 촉진합니다.
마찬가지로, 항체-약물 접합체(ADC)는 mAb의 정밀도와 암세포를 표적으로 삼는 세포독성제의 효능을 통합합니다. 이러한 mAb가 표적에 결합하면 ADC가 세포에 들어갑니다. 이어서, mAb 구성요소가 분해되어 세포독성 약물을 방출하여 건강한 세포를 보존하면서 암세포를 제거합니다. 주목할만한 예는 브렌 툭시 맙 베도 틴, 재발성 또는 저항성 호지킨 림프종(HL) 및 전신 역형성 대세포 림프종(ALCL) 치료에 사용됩니다. 브렌툭시맙은 암세포의 CD30 항원에 초점을 맞춰 항유사분열제인 모노메틸 아우리스타틴 E를 전달하여 세포를 효과적으로 죽입니다.
일부 mAb는 T 세포와 암세포 사이의 긴밀한 상호작용을 촉진하여 면역체계에 의한 암세포 제거를 돕습니다. 이 개념의 대표적인 예는 이중특이적 항체입니다. 특별히 조작된 이 mAb는 서로 다른 mAb의 세그먼트로 구성되며, 각각은 서로 다른 항원에 결합합니다. 한 부분은 암세포의 항원에 결합하는 반면, 다른 부분은 T 세포나 NK 세포와 같은 면역 세포와 결합하여 암세포와 연결되어 파괴를 촉진합니다. 엡코리타맙 미만성 거대 B세포 림프종 치료를 위해 FDA가 승인한 가장 최근의 mAb 중 하나로서 이러한 접근 방식의 좋은 예입니다. CD3 및 CD20에 대한 이중특이적 항체로 특별히 설계된 이 항체는 CD20 양성 악성 B세포에 대한 T세포 기반 세포독성 활성을 촉진합니다.
CAR-T 요법 항체 기반 분자를 활용하여 T 림프구를 키메라 항원 수용체(CAR) T 세포로 변형시키는 혁신적인 면역요법 접근 방식을 나타냅니다. 이러한 유전자 조작 CAR-T 세포는 표적 세포의 특정 항원을 인식하도록 설계되었습니다. 그들은 표적을 식별하는 단일 사슬 단일클론 항체 가변 영역을 통합하고 표적 세포를 만날 때 T 세포를 유발하는 활성화 막관통 도메인과 결합합니다. 특히, 이전에 mAb가 표적으로 삼았던 많은 항원이 이제 CAR-T 세포를 사용하여 해결됩니다. 선구적인 예는 B세포 급성 림프구성 백혈병(ALL) 치료를 위해 CD19를 표적으로 하는 FDA 승인 CAR-T 세포 치료법인 Tisagenlecleucel(Kymriah)입니다. 현재 FDA는 다양한 혈액암에 대한 XNUMX가지 CAR-T 세포 치료법을 승인했습니다.
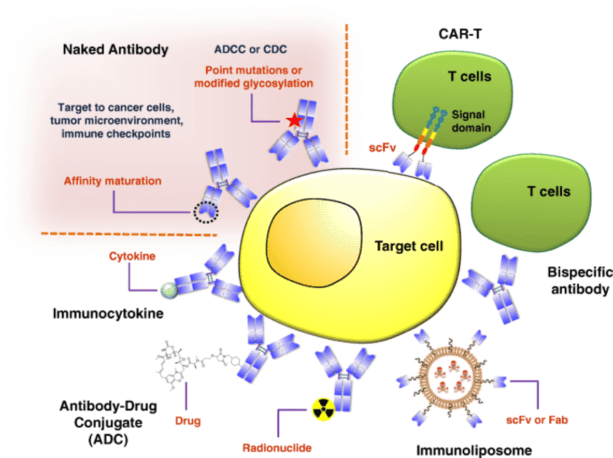
신용: Jin, S., Sun, Y., Liang, X. et al. doi.org/10.1038/s41392-021-00868-x.
다음에 따라 재생산됨 크리에이티브 커먼즈 라이센스
mAbs는 제약 혁신의 선도적인 영역으로 빠르게 부상하고 있으며, 향후 10년 동안 그 보급률이 급증할 것으로 예상됩니다. 아래에는 유럽 연합(EU)과 미국(US)에서 승인된 암 치료용 항체 치료제를 강조하는 요약표가 나와 있습니다.
| INN | 상표명 | 표적; 체재 | 1st 표시 승인됨 | 1st EU/US 승인 연도 |
| 엡코리타맙 | 엡킨리™ | CD20, CD3; 이중특이적 인간화 IgG1 | 미만성 거대 B 세포 림프종 | 2023 / 2023 |
| 니볼 루맙 | 오피도 | PD1; 인간 IgG4 | 흑색종, 비소세포폐암 | 2015 / 2014 |
| 오 비누 투 주맙 | 가지 바 | CD20; 인간화 IgG1; 글리코엔지니어링 | 만성 림프 구성 백혈병 | 2014 / 2013 |
| 페르 투 주맙 | 페르 제타 | HER2; 인간화 IgG1 | 유방암 | 2013 / 2012 |
| 브렌 툭시 맙 베도 틴 | 애드세트리스 | CD30; 키메라 IgG1, ADC | 호지킨 림프종, 전신 역형성 대세포 림프종 | 2012 / 2011 |
| 이필 리무 맙 | 예르 보이 | CTLA-4; 인간 IgG1 | 전이성 흑색종 | 2011 / 2011 |
| 베바 시주 맙 | 아바스틴 | VEGF; 인간화 IgG1 | 대장 암 | 2005 / 2004 |
| 이브리투모맙 티욱세탄 | 제 발린 | CD20; 쥐 IgG1 | 비호 지킨 림프종 | 2004 / 2002 |
| 트라 스투 주맙 | 허셉틴 | HER2; 인간화 IgG1 | 유방암 | 2000 / 1998 |
| 리툭 | 맙테라, 리툭산 | CD20; 키메라 IgG1 | 비호 지킨 림프종 | 1998 / 1997 |
참조 :
Chen YJ, Abila B, Mostafa Kamel Y. CAR-T: 다음은 무엇입니까? 암 (바젤). 2023년 21월 15일;3(663):10.3390. 도이: 15030663/cancersXNUMX.
Jin, S., Sun, Y., Liang, X. 외. 암 치료를 위한 새로운 치료용 항체 유도체의 출현. Sig Transduct Target Ther 7, 39 (2022). https://doi.org/10.1038/s41392-021-00868-x
Lu, RM., 황, YC., Liu, IJ. 외. 질병 치료를 위한 치료용 항체 개발. J Biomed Sci 27, 1 (2020). https://doi.org/10.1186/s12929-019-0592-z
와이너 GJ. 더 나은 단일클론항체 기반 치료제 개발. Nat 레브 암. 2015;15(6):361-370. doi:10.1038/nrc3930
Zahavi D, Weiner L. 암 치료의 단일 클론 항체. 항체(바젤). 2020년 20월 9;3(34):10.3390. 도이: 9030034/antibXNUMX

치료용 중간엽 줄기세포의 대규모 생산에 중요한 특수 배지, 세포 공장 및 GMP 준수 단백질을 찾아보세요.

MSC 회전타원체가 어떻게 치료를 강화하는지 알아보세요. 향상된 치료 결과를 위한 메커니즘, 생산 기술 및 생체 내 효과를 알아보세요.

인간화 마우스는 재생 의학을 위한 중간엽 줄기 세포(MSC)의 면역 조절 잠재력을 평가하기 위한 전임상 모델을 제공합니다. 이러한 모델이 다양한 질병에 대한 새롭고 안전한 세포 치료법을 개발하는 데 어떻게 도움이 되는지 알아보세요.

고객 관리, 영업 및 과학 지원에 문의하세요.

당사 제품 및 서비스에 대한 상담 및 질문

기술 및 안전 데이터 시트, 가이드 등의 문서화..