- 您的購物車是空的
- 繼續購物


一旦掌握了基礎知識(準備培養瓶、餵食細胞、匯合時傳代),細胞培養可能看起來很簡單,但真正的卓越之處在於細節。關鍵參數的微小偏差可能會為您的實驗帶來很大的不一致,從而導致意外的變化、細胞表型的喪失,甚至檢測失敗。
這不僅僅是關於技術:你使用的材料,例如你的基礎培養基(例如 記憶體, 轉速指數, 或者 的MEM) 和補充劑,例如 胎牛血清 (FBS),在影響細胞行為中發揮關鍵作用。培養基成分、血清批次品質或培養條件的變化會顯著影響生長率、活力、形態和實驗可重複性。即使使用值得信賴的品牌,監控和優化您的文化環境仍然至關重要。
無論您研究的是原代細胞、間質幹細胞或永生化細胞系,了解並追蹤特定的培養指標都可以確保細胞健康、提高可重複性並增強實驗結果。
在本文中,我們將重點放在 七個關鍵數字 每個研究人員都應該監測並解釋為什麼它們對於獲得一致、高品質的結果很重要。

傳代數 反映出一個細胞群被 亞培養 (分裂並重新接種到新的容器中)自最初分離或從冷凍保存中恢復以來。每次傳代都標誌著一輪細胞擴增和繁殖。
雖然傳代次數通常被視為常規指標,但它在確定 細胞品質、性能和實驗可重複性。隨著時間的推移,細胞在 體外 文化。這些變化可能導致行為發生重大轉變,例如基因表現改變、增殖減慢、生存能力降低或不必要的分化——即使細胞形態保持不變。
監測和記錄通道數量可確保:
未能追蹤通道數量可能導致 無法重複的結果, 誤導性結論和 浪費資源 — 尤其是在長期研究或臨床前開發過程。
在常規細胞培養中,每次傳代培養或重新接種都算是傳代。
然而,一個常見的問題出現了:
解凍冷凍細胞算不算新的傳代?
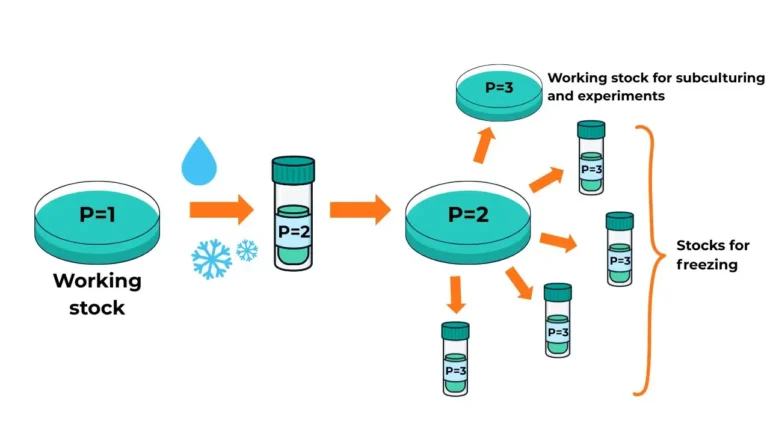
答案是: 沒有 — 通道數應隨 重新播種,不 冷凍.
示例:
如果你有一個工作細胞系 第1段(P1),然後用胰蛋白酶消化並冷凍這些細胞,然後把小瓶標記為 P2。解凍後,它們仍然 P2 直到你再次對它們進行亞培養,此時它們就變成了 P3.
傳代數 不考慮分流比或接種密度因此對細胞實際分裂次數的了解有限。
考慮這個場景:
然而,1:10 分裂的細胞必須增殖更多才能達到匯合,這意味著它們會經歷 人口倍增(PD)更多。 隨著時間的推移,即使傳代次數相同,也會導致細胞在基因和功能上有所不同。
監測 PD 與傳代次數、倍增時間可以 多維文化健康觀,從而能夠做出更好的決策,特別是在長期或轉化研究中。

細胞接種密度 — 每單位面積(對於貼壁細胞)或每單位體積(對於懸浮細胞)接種的細胞數 — 是 基本參數 在細胞培養中。它直接影響生長速度、形態、基因表現和下游檢測的結果。
播種不正確可能導致:
保持適當的播種密度可確保:
| 電池類型 | 推薦播種密度 |
| 貼壁細胞 | 5,000–50,000 個細胞/cm² |
| 懸浮細胞 | 2×104 至5×105 細胞/毫升 |
這些只是一般範圍。最佳密度會根據細胞類型、檢測類型、培養容器大小和實驗目標而變化。
專業貼士: 建議在解凍後立即接種比常規傳代期間更多的細胞,因為解凍後的細胞活力通常較低。
細胞密度需求差異很大,取決於:
查閱已發表的文獻並進行中試實驗以確定最適合您的特定係統的接種密度。適用於一個實驗室或細胞系的方法可能不適用於另一個實驗室或細胞系。
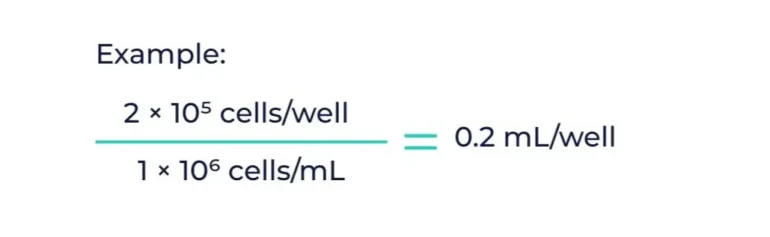
以下是幫助您計算實驗正確接種密度的快速指南:

示例: 您需要在 2 孔板中放置 10 × 6⁵ 細胞/孔。如果有 1 × 10⁶ 細胞/毫升,則每個孔需要 0.2 毫升。

細胞匯合度 指貼壁細胞覆蓋培養表面的百分比。它是細胞增殖和整體培養健康狀況的快速且重要的視覺指標。
匯合度不僅僅是一個常規指標,它還用於指導整個細胞培養工作流程的決策——從傳代和冷凍保存到實驗處理和分化。重要的是, 細胞行為, 基因表達和 對外界刺激的反應 都受到匯合水準的高度影響。
匯合度不是直接計數細胞,而是 表面覆蓋度的視覺評估。例如,70%匯合的燒瓶有70%的表面積被黏附細胞佔據。
如果使用得當,匯合度有助於確定:

未能在正確的時間傳球可能導致:
儘管匯合度很重要,但通常仍透過顯微鏡下的肉眼來評估。這種「估計」是主觀的,並且可能因使用者而異——即使是同一個人在不同的日子。估計 60–90% 的匯合度(許多程序中最關鍵的範圍)特別容易出錯。
準確且一致地估計匯合支援:
| 應用產業 | 目標匯合度 | 合理 |
| 增殖試驗 | 60-80% | 確保積極成長 |
| 轉染/轉導 | 70-90% | 平衡生存力和最佳吸收 |
| 區別 | 因細胞類型而異 | 有些要求高密度;其他的則需要空間來進行形態發生的變化 |
| 冷凍保存 | 70-90% | 讓細胞處於最佳健康狀態,以便解凍後恢復 |
| 解凍後膨脹 | 50-70% | 防止過度擁擠並支持健康再生 |
過度匯合是一個可預防的問題,但它可能會破壞整個實驗。使用這些主動策略:

細胞活力 是整體細胞健康的關鍵指標,對於確保可靠和可重複的實驗結果至關重要。無論您進行轉染、藥物測定、分化研究或準備細胞進行冷凍保存,保持高活力百分比都有助於確保一致且生理相關的結果。
生存能力低下會導致:
FBS 是許多培養基配方中最關鍵的成分之一。它提供 必需生長因子、荷爾蒙、黏附分子以及支持 細胞附著、增殖和存活.
運用 值得信賴的高品質FBS 對於維持生存至關重要,因為:
專業建議: – 始終從信譽良好的供應商處採購胎牛血清,這些供應商應提供:
高生存力不僅意味著生存,還意味著 確保你的細胞健康、活躍並表現正常。值得信賴的試劑如 認證FBS 形成可靠文化體系的骨幹。

支原體污染 是細胞培養中最隱密且最難診斷的問題之一。與細菌或真菌污染不同,支原體不會引起培養基混濁,而且常常不被注意,但會默默地破壞實驗的完整性。
這些微小的、無細胞壁的細菌可以:
| 情況 | 測試頻率 |
| 常規細胞培養維護 | 每4-6週 |
| 在關鍵實驗之前 | 至少提前一周 |
| 冷凍保存細胞庫存前 | 強制性 |
| 解凍儲存的細胞後 | 解凍後 3-5 天內 |
| 獲得新的細胞系後 | 抵達後立即 |
| 抗生素治療後或疑似污染後 | 需要進行後續測試 |
主動、定期的支原體檢測和頻繁 支原體淨化實踐 只要投入少量的時間,就能節省數月的勞動時間。


培養基pH值 在影響力方面發揮著至關重要的作用 細胞活力、新陳代謝、酵素活性和 整體實驗可重複性。任何偏離最佳 pH 範圍的情況都可能導致細胞行為改變、數據不可靠,甚至培養完全失敗。維持穩定的 pH 值對於敏感細胞類型(例如原代細胞和幹細胞)尤其重要。
哺乳動物細胞的最佳pH值範圍通常在 7.2 – 7.4。 pH 值低於 7.2 被視為酸性,而 pH 值高於 7.4 被視為鹼性。
酸性條件 – 通常表示 過度生長的文化 或可能 微生物污染。當細胞代謝營養物質時,它們會釋放乳酸等酸性副產物,從而降低 pH 值。這在密集的文化中或當培養基變化不頻繁時尤其常見。
鹼性條件 – 可能源自於 二氧化碳不足₂ 各級 在孵化器中或 延長曝露 培養皿中的空氣。當細胞代謝不活躍時,例如細胞死亡後或解凍後的早期階段,也會發生這種情況。
酚紅是細胞培養基中常見的 pH 指示劑,它會從粉紅色(中性)變為橙色或黃色(酸性),從而 視覺提示 即時監控媒體狀況。培養基變黃表示酸度增加,通常表示需要更換培養基,無論預定的餵食時間表如何。

在大多數情況下,酚紅是無害的,並且有助於維持健康的培養。然而,某些 敏感細胞系或實驗裝置 可能需要 無酚紅培養基。這是因為酚紅表現出弱的雌激素樣活性,可以影響激素反應細胞或乾擾對雌激素化合物敏感的檢測。它也可能在流式細胞儀或螢光分析等技術中引起背景訊號。對於這些情況,最好使用不含酚紅的配方。
碳酸氫鈉 (NaHCO₃) 是一種天然、無毒的緩衝液,常用於細胞培養基。需要 5% 二氧化碳培養箱 起到緩衝作用,因為二氧化碳溶解在培養基中,形成碳酸,碳酸與碳酸氫根離子相互作用, 穩定pH值.
培養基中的 NaHCO₃ 量決定了維持 pH 值所需的 CO₂ 量。一般認為正常組織的生理 pH 值在 7.2 至 7.4 範圍內,但某些疾病狀態(例如癌症)可能需要在較低的 pH 值下進行培養。添加 Earle 平衡鹽溶液 (EBSS) 的 Eagle 最低必需培養基 (EMEM) 和大多數其他細胞培養基通常含有 26mM 碳酸氫鈉,而 DMEM 的濃度更高,為 44mM。

HEPES(4-(2-羥乙基)-1-哌嗪乙磺酸)是一種 兩性離子有機緩衝液 廣泛用於細胞培養以維持穩定的pH值,特別是在二氧化碳水平可能波動的環境中。 HEPES 在 pH值範圍為6.8至8.2,使其適用於多種哺乳動物細胞系。
生物西 提供廣泛的基礎培養基配方,以滿足研究不同細胞類型和實驗條件的研究人員的不同需求。無論是培養強大的永生細胞系、敏感的原代細胞或幹細胞,Biowest 都能提供 即用型培養基 含或不含 HEPES 和碳酸氫鈉,以支持最佳 pH 控制和緩衝。
標準選項包括:

內毒素,也稱為 脂多醣(LPS), 是革蘭氏陰性菌外膜的組成部分。這些分子可以在細菌生長過程中少量釋放,在細菌裂解時大量釋放。即使是微量的內毒素也會損害培養細胞的健康,特別是在幹細胞擴增、免疫療法開發、生物生產或發炎疾病建模等敏感應用中。它們的影響通常很微妙,但可能導致不穩定、不可重複或誤導的實驗結果。
即使濃度較低,內毒素也能:
特別容易受到內毒素影響的細胞類型包括:
內毒素可以透過多種途徑進入您的培養系統:
使用無內毒素水或超純水 – 用於製備緩衝液、清洗玻璃器皿或稀釋培養基的水必須是高純度的(例如,I 型超純水)並且經過認證不含內毒素。
選擇優質、低內毒素的FBS – FBS 是內毒素的常見來源。選擇經供應商認證的低內毒素水平批次——對於一般工作,理想情況下內毒素水平低於 10 EU/mL,對於敏感應用,理想情況下內毒素水平低於 1 EU/mL。 百奧西胎牛血清 經過 LAL 測試並提供批次特定證書。
確認培養基和添加劑的內毒素檢測 – 確保基礎培養基、補充劑(例如生長因子、抗生素)和緩衝液在嚴格的品質控制下生產,並經過內毒素污染測試。
遵循正確的玻璃器皿高壓滅菌程序 – 殘留內毒素具有熱穩定性,因此要確保玻璃器皿不僅要經過滅菌,而且在必要時還要進行去熱原處理-通常採用≥250°C 的乾熱滅菌,持續 30 分鐘。
使用經認證的無內毒素塑膠器皿 – 選擇經製造商認證為無內毒素的一次性塑膠器皿(例如,移液管吸頭、試管、燒瓶)。避免重複使用或清洗可能暴露於環境污染物的實驗室器皿。
盡量減少接觸環境污染物 – 在無菌環境中快速工作。僅在層流罩下打開培養容器,並減少培養箱外的處理時間,以最大限度地降低環境內毒素暴露的風險。
比奧韋斯t提供 FBS 和基礎培養基 經過 LAL 測試並提供 批次特定分析證書 內毒素水平,確保 一致性和可靠性 跨實驗。其嚴格的品質控制流程支援可重複的高效能結果—即使在最敏感的應用中也是如此。
Biowest 的 超低內毒素胎牛血清 是專門為滿足敏感細胞培養系統的嚴格要求而設計的。每批都經過精心配製和徹底測試,符合嚴格的內毒素閾值,使其成為培養原代細胞、幹細胞和用於臨床或生物製藥應用的細胞的理想選擇。有了 Biowest,您可以放心,您的細胞在支持以下兩種環境的環境中生長: 生存力和完整性.
細胞培養既是一門數位科學,也是一門技術科學。掌握關鍵的定量參數—例如 傳代次數、接種密度和匯合率—可能意味著可重複的結果和實驗失敗之間的差異。同樣重要的是不太明顯但關鍵的指標,例如 活力、支原體檢測頻率、培養基 pH 值和內毒素水平。這七個數字共同構成了強大、可靠的細胞培養系統的基礎。透過保持警惕並了解這些價值觀,研究人員可以提高一致性,保護細胞健康,並確保有意義的結果——無論是使用標準細胞系還是推進敏感的臨床應用。
Bio,C.(2024 年 19 月 XNUMX 日)。 了解細胞培養基中的 pH 值和滲透壓。吸引生物。 https://captivatebio.com/understanding-ph-osmolality-cell-culture-media/
細胞培養:技術、類型和生長監測 |丹納赫生命科學。 (nd)。丹納赫生命科學公司。 https://lifesciences.danaher.com/us/en/library/cell-culture.html#:~:text=The%20optimal%20CO2%20level%20for,can%20be%20toxic%20to%20cells.
細胞培養實驗室中的二氧化碳濃度和pH值控制。 (nd)。文化收藏。 https://www.culturecollections.org.uk/culture-collection-news/co2-concentration-and-ph-control-in-the-cell-culture-laboratory/
維持細胞 | ATCC。 (nd)。 https://www.atcc.org/the-science/culturing-cells/maintaining-cells
Office,S.(2025 年 25 月 XNUMX 日)。 IND 應用的細胞和基因治療的 CMC 要求 |生物阿吉利特。 BioAgilytix。 https://www.bioagilytix.com/blog/cmc-requirements-for-cell-and-gene-therapy-for-ind-applications/
活細胞百分比。 (nd)。科學直接。 https://www.sciencedirect.com/topics/immunology-and-microbiology/percentage-of-viable-cells


Biowest 與通用血清:為什麼品質對細胞培養如此重要。使用可信賴的試劑確保可重複性和可翻譯性。了解更多。

通知