- 您的購物車是空的
- 繼續購物
在以下趨勢的推動下,癌症治療領域正在經歷變革:iPSC 衍生的 MSC、MSC 衍生的 EV 以及 Cas9 介導的 MSC 基因編輯。 iPSC 衍生的 MSC 提供了可擴展且標準化的細胞來源,克服了與傳統收穫方法相關的限制。 MSC 衍生的 EV 成為一種有前景的無細胞治療工具,具有靶向藥物傳輸能力和較低的免疫原性。同時,Cas9介導的基因編輯能夠精確控制間質幹細胞的行為,並提高其治療效率。這些創新共同推動了該領域的發展,為個人化、有效和更安全的癌症治療開闢了途徑。 StemCell Express 真正走上了進步的軌道,為對抗癌症的光明未來帶來了希望。
幹細胞已成為癌症治療基因和細胞療法不斷發展的關鍵參與者,具有解決這種疾病複雜性的巨大潛力。各種幹細胞,包括造血幹細胞(HSC)、誘導性多能幹細胞(iPSC)和間質基質/幹細胞(MSC)已被用於細胞治療,並取得了可喜的結果。這些多功能細胞可用於傳遞治療基因,提供有針對性的精確方法來對抗腫瘤。此外,幹細胞表現出獨特的特性,包括調節免疫系統的能力,使它們成為增強人體對癌症的自然防禦能力的寶貴資產。
在各種幹細胞類型中,間質幹細胞是特別有前途的候選細胞。間質幹細胞可進行工程設計並能夠歸巢到腫瘤部位,具有雙重優勢:提供治療有效載荷並促進針對癌細胞的免疫反應。將間質幹細胞整合到基因和細胞治療策略中,有可能重塑癌症治療範式,為患者提供新穎的個人化解決方案。
透過這一系列 Stem Cell Express 了解使用 MSC 進行癌症治療的最新趨勢和進展。
目前臨床試驗中使用的間質幹細胞主要透過侵入性操作從脂肪組織、臍帶或骨髓中獲取。間質幹細胞的擴增能力有限,需要重複的分離程序才能滿足細胞治療的需求,加上與此相關的高成本 體外 擴展,限制了它們的臨床可及性和廣泛採用。傳統方法的特點是增殖潛力有限和供體之間存在差異,導致臨床試驗結果不一致。
確定適當的捐贈者來源或探索 MSC 生產的替代方法對於解決阻礙大規模 MSC 生產的現有瓶頸至關重要。
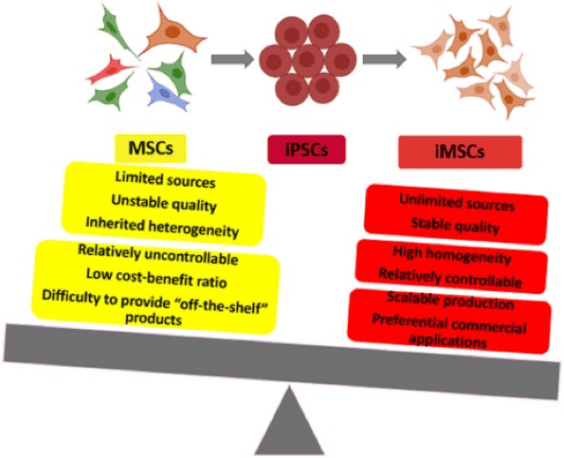
iPSC 代表了再生醫學的革命性進步,提供了產生用於治療目的的各種細胞類型的潛力。 iPSC 具有高度的自我更新能力、增殖能力以及向中胚層、內胚層和外胚層分化的能力,繞過了與胚胎幹細胞 (ESC) 相關的倫理問題。在 iPSC 可以產生的各種細胞譜系中,MSC 是一個特別有價值的細胞群。
使用 iPSC 衍生的 MSC 的優勢在於克服了從成體組織中收穫 MSC 的局限性,包括侵入性操作和有限的細胞產量。 iPSC 衍生的 MSC 可以大量生成,提供一致且可擴展的細胞來源。此外,這些細胞可以潛在地解決與捐贈者變異性和年齡相關變化相關的問題,從而提供更標準化和可靠的細胞產品。 iPSC 的多能起源增強了其治療應用的可擴展性和可重複性。值得注意的是,iPSC 來源的 MSC 在形態、免疫表型和三譜系分化能力方面與組織來源的 MSC 非常相似,同時在動物疾病模型中表現出更強的再生能力。
2017年,Cynata Therapeutics進行了全球首個同種異體iPSC衍生細胞產品的正式1期試驗(編號NCT02923375) (CYP-001) 患有類固醇抗性(SR)急性移植物抗宿主疾病(aGVHD)的成人。該試驗表明,在有限數量的 SR-aGVHD 受試者中,CYP-001 是安全且可耐受的。儘管需要進行更大樣本量的進一步試驗來確認療效,但觀察到的 aGvHD 反應令人鼓舞,為利用 iPSC 衍生的 MSC 治療各種疾病鋪平了道路。總之,該試驗的令人鼓舞的結果表明,iPSC 衍生的MSC 不僅在治療類固醇抗藥性的急性移植物抗宿主疾病(SR-aGVHD)方面表現出安全性和耐受性,而且還為其在癌症治療中的應用開啟了新的視野。 iPSC 衍生的 MSC 具有大規模生產穩定且可持續的「現成」產品的潛力,是解決免疫性疾病和癌症治療中複雜挑戰的多功能且令人鼓舞的資源。
近年來,源自間質幹細胞的細胞外囊泡(EV)已成為一種有前景的藥物遞送平台,利用其固有的生物相容性和靶向遞送能力,將其與脂質體等人造奈米載體區分開來。研究表明,MSC 的許多旁分泌功能,包括生長因子、細胞因子、趨化因子和 EV 的釋放,有助於其治療效果。
EV 可以根據大小進行分類:外泌體 (30-150 nm)、微泡 (150-500 nm) 和凋亡小體 (800-500 nm)。 MSC 衍生的 EV 反映了 MSC 的生物潛力,為 MSC 細胞療法提供了更安全的替代方案,後者可能容易受到肺部微脈管系統中遺傳或表型變化和聚集的影響。
MSC-EV基於這些原因,為實現無細胞療法提供了一個有趣的選擇,特別是其在癌症治療中的潛力而引人注目。除了其固有的和特定目標的歸巢能力之外,MSC-EV 還可以保護生物貨物(包括 miRNA 和 mRNA)免受降解 体内。此外,與MSC相比,MSC-EV表現出較低的免疫原性,並且可以進行基因改造以提高組織靶向效率,作為抗癌藥物和生物製劑的有效載體,從而克服癌症治療中的抗藥性性。
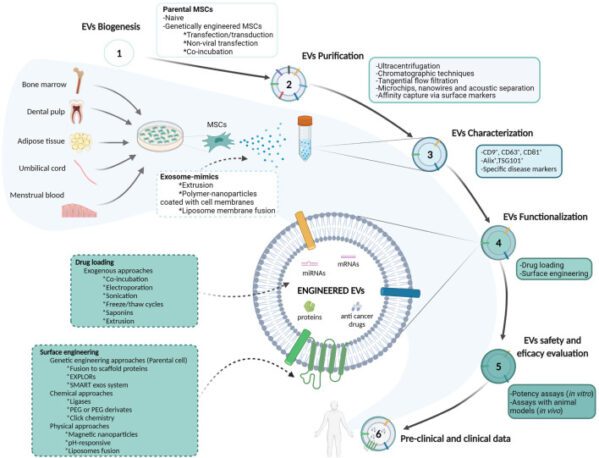
探索 MSC-EV 的臨床試驗涵蓋多種適應症,例如 COVID-19、糖尿病、阿茲海默症,尤其是癌症治療。第一階段試驗(NCT03608631)目前正在針對胰臟癌中的 KRAS G12D 突變進行治療。 KRAS G12D 是胰臟癌的常見突變,是專門針對這種突變的治療的重點。研究人員正在評估攜帶 KrasG12D siRNA 的 MSC-EV 在轉移性胰臟癌患者中的安全性和合適劑量。
儘管 MSC-EV 有望成為臨床癌症治療的新型無細胞治療工具,但挑戰仍然存在。用於異構 MSC-EV 的隔離和表徵的標準化協議勢在必行。由於已記錄的促腫瘤特性、其他細胞的內化以及巨噬細胞的清除,安全性和有效性問題引起了人們的關注。天然 MSC-EV 的產量低及其在藥物傳遞方面的有限功效強調需要進一步的臨床前和臨床研究,以推動 MSC-EV 療法進入廣泛的臨床應用。
儘管間質幹細胞因其固有的優勢和有益特性而受到廣泛關注,但完整形式的間質幹細胞的應用存在一定的局限性。間質幹細胞可能無法有效地導航到特定的目標組織或腫瘤,這限制了它們將治療劑精確地遞送到作用部位的能力。此外,這些細胞在給藥後在體內的持續時間可能有限,需要重複劑量才能獲得持續的治療效果。人們也擔心間質幹細胞在完整施用時有可能分化成非預期的細胞類型或表現出不可預測的行為 体内,強調需要精確控制自己的行為。
為了克服這些挑戰,建議採用多種方法透過基因改造來提高 MSC 效率。為此目的,採用了多種技術,包括病毒載體(慢病毒載體/腺病毒載體)、質粒轉染、電穿孔、轉座子、奈米顆粒介導的遞送和革命性的CRISPR/Cas9技術。
在這些方法中,CRISPR/Cas9作為一種高效的基因編輯工具脫穎而出,被科學界廣泛接受。其首次臨床應用 贊同 在英國,用於治療鐮狀細胞疾病和輸血依賴性β地中海貧血(TDT)的藥物為解決一系列疾病鋪平了道路。在癌症治療中,CRISPR/Cas9 在基因工程免疫細胞(尤其是 T 細胞)方面越來越受到重視,以增強其對抗腫瘤的有效性。
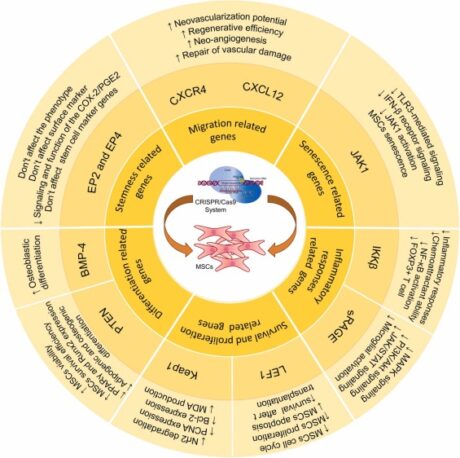
CRISPR/Cas9 的顯著特徵之一是它能夠同時針對多個基因序列,這使其成為與其他基因編輯技術相比更具成本效益的選擇。 CRISPR/Cas9編輯的MSCs的應用是多種多樣的,包括保留MSC乾性、減少MSC老化和凋亡以及增強MSC存活和免疫調節特性。每項修改的策略目的都是為了提高 MSC 的治療效率。圖 9 總結了 MSCs 研究的 CRISPR/Cas3 工程結果,突顯了這種基因編輯工具在提高 MSCs 治療能力方面的變革潛力。
參考
Abdal Dayem A、Lee SB、Kim K、Lim KM、Jeon TI、Seok J、Cho AS。透過幹細胞重編程生產間質幹細胞。國際分子科學雜誌。 2019 年 18 月 20 日;8(1922):10.3390。 doi:20081922/ijms31003536。電話號碼:6514654; PMCID:PMCXNUMX。
Bloor AJC、Patel A、Griffin JE 等人。 iPSC 衍生的間質基質細胞在急性類固醇抗性移植物抗宿主疾病中的生產、安全性和功效:一項 I 期、多中心、開放標籤、劑量遞增研究。納特醫學。 2020;26(11):1720-1725。 doi:10.1038/s41591-020-1050-x
Dalmizrak A, Dalmizrak O. 間質幹細胞衍生的外泌體作為在癌症治療中遞送 miRNA 的新工具。 前沿生物工程生物技術。 2022;10:956563。發佈於 2022 年 26 月 10.3389 日。doi:2022.956563/fbioe.XNUMX
Golchin A、Shams F、Karami F。利用 CRISPR/Cas9 推進間質幹細胞治療的臨床試驗研究。高級實驗醫學生物學。 2020;1247:89-100。 doi:10.1007/5584_2019_459
Hazrati A、Malekpour K、Soudi S、Hashemi SM。 CRISPR/Cas9 工程改造的間質基質/幹細胞及其細胞外囊泡:克服細胞治療限制的新方法。生物醫學藥劑師。 2022;156:113943。 doi:10.1016/j.biopha.2022.113943
Lotfy A,AboQuella NM,Wang H。臨床試驗中的間質基質/幹細胞(MSC)衍生的外泌體。幹細胞研究。 2023;14(1):66。 2023 年 7 月 10.1186 日發布。doi:13287/s023-03287-7-XNUMX
Phelps J、Sanati-Nezhad A、Ungrin M、Duncan NA、Sen A。間質幹細胞及其衍生物的生物加工:邁向無細胞治療。 幹細胞國際。 2018;2018:9415367。發佈於 2018 年 12 月 10.1155 日。doi:2018/9415367/XNUMX
Sanmartin MC、Borzone FR、Giorello MB、Yannarelli G、Chasseling NA。間質基質細胞衍生的細胞外囊泡作為癌症治療中藥物輸送的生物載體。 前沿生物工程生物技術。 2022;10:882545。發佈於 2022 年 14 月 10.3389 日。doi:2022.882545/fbioe.XNUMX
Shan C,Liang Y,Wang K,Li P。間質幹細胞衍生的細胞外囊泡在癌症治療抵抗中的作用:從生物學到臨床機會。國際生物科學雜誌。 2024;20(1):347-366。 2024 年 1 月 10.7150 日發布。doi:88500/ijbs.XNUMX
張傑,陳明,廖傑,等。誘導多能幹細胞衍生的間質幹細胞異質性較低,在生物學研究和臨床應用上具有廣闊的前景。 Front Cell 開發生物學。 2021;9:716907。 2021 年 30 月 10.3389 日發布。doi:2021.716907/fcell.XNUMX


探索為什麼 FBS 可追溯性在癌症研究中至關重要。了解 ISIA 認證和值得信賴的血清產品,以獲得可靠的結果。