- 您的购物车是空的
- 继续购物

液体活检分析已成为精准医疗领域的一项突破性工具,它通过血液、尿液、唾液和脑脊液等体液中的生物标志物,提供了一种微创的疾病检测和监测方法。与需要手术提取的传统组织活检不同,液体活检是非侵入性的,依赖于检测细胞释放到血液或其他体液中的成分。这些成分也称为生物标志物,包括循环肿瘤 DNA (ctDNA)、循环肿瘤细胞 (CTC)、RNA、蛋白质和细胞外囊泡 (EV)。其中,EV 因其在细胞间通讯和疾病进展中的作用而备受关注。然而,从复杂的生物体液中分离高质量的 EV 面临着一些挑战。本博客探讨了这些挑战,并介绍了 Izon qEV 系统作为应对这些挑战的强大解决方案。
从液体活检中分离 EV 是一个很有前景但又充满挑战的过程,原因如下:
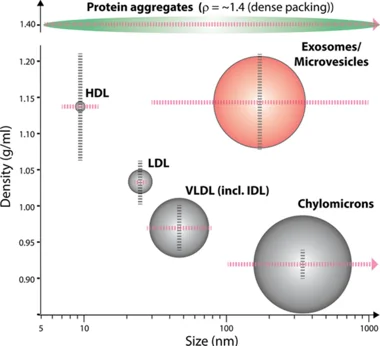
血浆、尿液、母乳和唾液等生物体液含有多种蛋白质、脂质、核酸和其他颗粒。例如,血浆非常复杂,由可溶性蛋白质(如白蛋白和 脂蛋白 例如高密度脂蛋白 (HDL)、低密度脂蛋白 (LDL)、中密度脂蛋白 (IDL)、极低密度脂蛋白 (VLDL) 和乳糜微粒。这些脂蛋白与 EV 具有几个重叠的特征,包括大小、密度和脂质含量,因此很难将 EV 与污染物分离。
超速离心 (UC) 和沉淀等技术容易发生非特异性结合,导致脂蛋白、蛋白质聚集体和游离核酸等污染物被同时分离。超速离心 (UC) 利用重力使 EV 沉淀,通常会导致与 EV 具有相似物理特性的颗粒被同时纯化,从而降低分离过程的特异性。基于沉淀的方法(例如使用聚乙二醇 (PEG) 的方法)也面临类似的挑战,因为这些聚合物会聚集 EV 和非 EV 成分,从而污染样品并使下游分析复杂化。
尺寸排阻色谱法 (SEC) SEC 采用一种充满多孔珠子的色谱柱,根据重力大小分离颗粒。较小的颗粒较慢地通过色谱柱,而较大的颗粒(如 EV)则被排除在孔隙之外,移动速度更快。这种分离可收集尺寸丰富的 EV,同时最大限度地减少较小蛋白质、核酸和脂蛋白的污染。因此,SEC 因其能够实现高纯度、可重复性和温和的分离过程而脱颖而出,可保持 EV 的完整性——使其成为液体活检分析的理想选择。
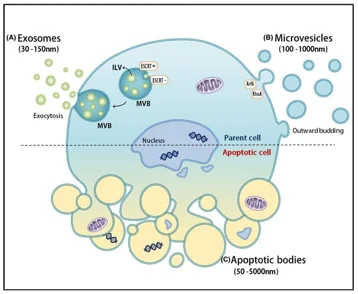
电动汽车的尺寸差异很大,尺寸从 30 到 5000 纳米不等,包括外泌体、微囊泡和其他囊泡结构,每种结构都具有不同的生物学作用。EV 亚型之间缺乏明确的界限,以及源自不同细胞类型和组织的生物学变异性使分离和标准化变得复杂。蛋白质、脂质和核酸谱的变化,以及密度和电荷等物理特性的变化,使得从不同的生物体液和临床条件下分离 EV 变得更加复杂。
Izon qEV 平台的主要优势之一是它能够在 EV 分离中实现卓越的纯度。qEV Gen 2 系列(现已淘汰的 Legacy 系列的改进版)可以从血浆中去除 99.4% 的蛋白质、99.9% 的 ApoA1(HDL)和 99% 的 ApoB(IDL、LDL 和 VLDL)。这些高去除效率确保 EV 样本高度富集且不含污染物,这对于准确的下游分析(例如蛋白质组学、转录组学和功能分析)至关重要。能够以如此高的纯度分离 EV 不仅提高了研究结果的可靠性,而且使 qEV 平台成为液体活检应用的上佳选择。
一些技术限制影响了 EV 分离的效率、可扩展性和标准化。许多方法(例如 UC 和沉淀)的回收率较低,并且产生的 EV 纯度不稳定。这种多变性可能会影响组学研究或功能分析等下游应用。此外,UC 需要大量劳动力和时间,并且需要昂贵的专用设备,因此不适合常规临床使用。微流体或自动化系统等较新的方法提供了更好的可扩展性,但由于成本高昂且需要进一步验证,因此尚未被广泛采用。此外,实验室之间缺乏标准化协议导致 EV 产量、纯度和完整性不一致,因此可重复性成为确保研究和临床应用一致性和可靠性的重大挑战。
可扩展性和可重复性对于推进 EV 研究至关重要,尤其是随着研究和临床环境中对大规模 EV 分离的需求不断增长。然而,EV 分离技术会显著影响结果的可重复性和可扩展性。
UC 是一种常用的分离方法,但由于超速离心机型号、转子和操作员操作方式不同,不同实验室的重现性较差。这些因素导致 EV 产量和质量不一致,样品粘度的差异和方案变化使该过程进一步复杂化。因此,UC 通常缺乏可扩展、可靠的 EV 分离所需的一致性。
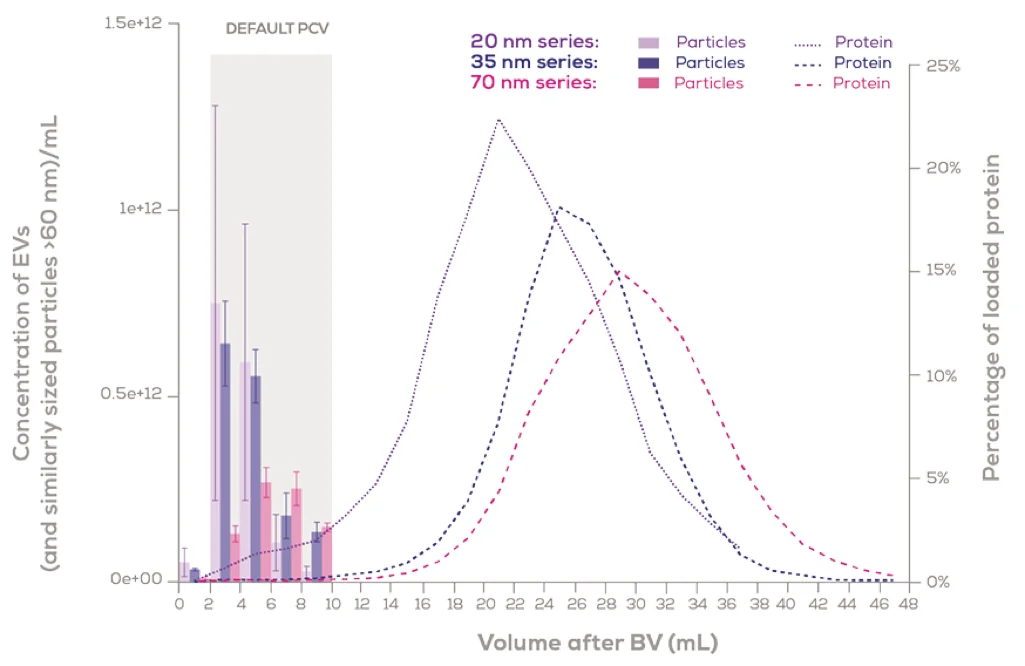
Izon qEV 平台通过其标准化的 SEC 方法解决了这些挑战。该系统的一个关键功能是自动馏分收集器 (AFC),它在提高可重复性和可扩展性方面发挥着关键作用。通过自动收集纯化的 EV 馏分并在收集时精确称重,AFC 可确保纯化收集体积 (PCV) 在分离过程中保持一致。这种标准化减少了用户引入的变化,例如每个馏分的体积差异,否则可能会导致不一致并影响结果。
此外,AFC 允许用户根据其特定样本类型或下游应用需求对 PCV 进行编程。这种灵活性提高了可扩展性,确保可以调整 EV 隔离以适应各种样本量和研究要求,使其既适合小规模研究也适合高通量应用。
qEV 柱和 AFC 系统共同提供了卓越的可扩展性和可重复性,使研究人员能够在样本、用户和实验室之间一致地进行 EV 分离。这种组合确保了可靠、可比的结果,这对于推进研究和将研究成果转化为临床应用至关重要。
在分离过程中保持 EV 的完整性至关重要,因为某些技术可能会损坏或改变其结构。例如,UC 产生的剪切力会使 EV 碎裂,破坏表面蛋白、脂质和 RNA,从而导致结果不可靠。依赖于 PEG 等试剂的沉淀方法的化学改变也会留下干扰后续分析(如蛋白质组学或 RNA 测序)的残留物。这些变化可能会损害 EV 的生物活性,特别是在功能特性至关重要的治疗应用中。
Izon qEV 平台的温和特性是另一个关键优势。与 UC 等方法不同,这些方法会施加很大的力,从而损坏或碎裂 EV,而 SEC 则通过重力分离颗粒,而无需使用强力。这可最大程度地减少剪切应力,并确保 EV 保持其结构和功能完整性。表面蛋白、脂质和 RNA 含量得以保留,这对于确保 EV 具有生物活性并可用于下游分析至关重要。这种温和的方法在分离用于治疗应用的 EV 时尤其重要,因为保持 EV 的生物学特性对于其有效性至关重要。
最后,基于 EV 的技术的临床应用面临 重大的挑战 可重复性和法规遵从性。患者之间的生物体液差异(例如样本成分和 EV 丰度的差异)使得获得一致的分离结果变得困难。缺乏标准化协议通常会导致 EV 的产量、纯度和完整性不一致,从而阻碍其在诊断和治疗中的应用。此外,监管障碍使 EV 分离方法的临床转化变得复杂。机构需要进行广泛的验证以证明基于 EV 的诊断工具或疗法的安全性、有效性和可靠性,这涉及确保可扩展性、可重复性和明确的质量控制标准。缺乏普遍接受的 EV 特性和功能基准进一步增加了监管的复杂性。
克服这些挑战需要强大而可靠的 EV 分离技术。一个关键方面是建立标准化协议和自动化操作,以确保不同实验室和实验之间的 EV 分离一致,从而实现可靠的下游分析和临床转化。

分离 EV 的方法可以极大地影响样品的纯度、质量和实用性。2018 年的一项研究 斯特兰斯卡 等.,发表于 转化医学杂志,对使用 qEV 柱的 SEC 与基于 exoEasy 膜亲和力的试剂盒从人血浆中分离外泌体样囊泡 (ELV) 进行了全面比较。
研究的主要见解
qEV 柱在将 EV 与污染的血浆蛋白和脂蛋白分离方面表现出色。所得富含 EV 的馏分杂质极少,这是下游应用的关键因素。相比之下,exoEasy 试剂盒的蛋白质含量高,颗粒与蛋白质的比率低,外泌体相关标记物无法检测到或含量很低。这些发现表明,exoEasy 分离物经常被非 EV 血浆蛋白和脂蛋白污染,从而降低了样品纯度。
*请注意,该工作流程已使用 qEV Legacy 柱进行了优化,但该柱已被 qEV Gen 2 柱取代,可以分离脂蛋白污染最低的 EV。
EV 正在成为基于液体活检的癌症诊断的有前途的生物标记物,但标准化分离方法的挑战阻碍了临床转化。这 根据一项研究, 比较了三种商业试剂盒(两种 SEC 试剂盒(qEV35 和 qEV70)和 ExoQuick Ultra 聚合物沉淀试剂盒)用于从人血浆中分离 EV,重点关注质量、纯度和临床相关性。
主要发现要点
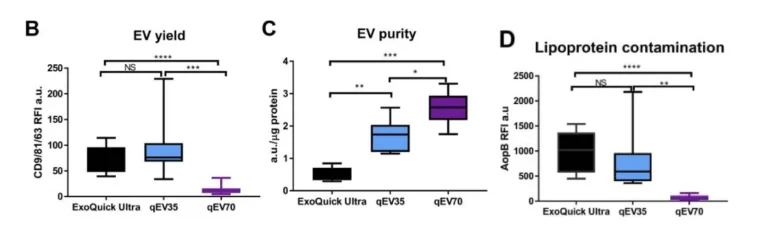
分离方法的选择可以决定基于 EV 的研究和临床诊断的成功与否。从比较研究中收集到的见解强调了为什么 qEV 平台 仍然是 EV 隔离的基准,特别是对于需要精度、纯度和可扩展性的应用。
qEV 平台的主要优势:
为什么重要意义
EV 作为癌症诊断和其他疾病的生物标记物具有巨大潜力。然而,基于 EV 的研究的可靠性取决于分离囊泡的质量。qEV 平台让研究人员确信他们的分离物尽可能纯净和可重复,解决了历史上阻碍临床应用的关键挑战。通过选择 qEV 平台,研究人员不仅可以提高数据质量,而且距离实现 EV 生物标记物的临床前景更近了一步。
在精准至上的领域,qEV 平台是推进 EV 研究和诊断的可靠盟友。准备好提升您的 EV 分离流程了吗?了解更多关于 Izon qEV 平台及其在液体活检分析中的应用,请访问 联系我们 直!
参考文献:
Nieuwland R、Enciso-Martinez A、Bracht JWP。细胞外囊泡领域的临床应用和挑战。Med Genet。2023 年 5 月 35 日;4(251):258-10.1515。doi:2023/medgen-2062-38835736。PMID:11006345;PMCID:PMCXNUMX。
Pang B, Zhu Y, Ni J, Ruan J, Thompson J, Malouf D, Bucci J, Graham P, Li Y. 三种商用试剂盒分离的血浆来源的细胞外囊泡在前列腺癌诊断中的质量评估与比较。国际纳米医学杂志。2020 年 15 月 15 日;10241:10256-10.2147。doi:283106/IJN.S33364756。PMID:7751609;PMCID:PMCXNUMX。
罗伊,S.;林,H.-Y.;周,C.-Y.;黄,C.-H.;小,J.;萨迪克,N.;艾农,CM;兰斯伯里,E.;克鲁兹,L.;叶库拉,A.;等人。探索肿瘤细胞外囊泡异质性。国际。 J.莫尔。科学。 2019 年 20 月 1349 日。 https://doi.org/10.3390/ijms20061349
Simonsen JB。我们在关注什么?细胞外囊泡、脂蛋白还是两者兼有?Circ Res。2017 年 29 月 121 日;8(920):922-10.1161。doi:117.311767/CIRCRESAHA.28963190。PMID:XNUMX。
Stranska, R., Gysbrechts, L., Wouters, J. 等。基于膜亲和力的方法与尺寸排阻色谱法从人血浆中分离外泌体样囊泡的比较。J Transl Med 16, 1 (2018)。 https://doi.org/10.1186/s12967-017-1374-6

探索超越PKH的可靠EV标记。探索Biotium的ExoBrite™染色剂,实现准确、可重复的细胞外囊泡分析。

