โมโนโคลนอลแอนติบอดี (mAbs) คืออะไร?
ระบบภูมิคุ้มกันของเราสร้างแอนติบอดีจำนวนนับไม่ถ้วน ซึ่งแต่ละชนิดได้รับการปรับแต่งเพื่อระบุโปรตีนจำเพาะที่เรียกว่าแอนติเจนบนพื้นผิวของเซลล์แปลกปลอม เมื่อแอนติบอดีจับกับแอนติเจนจำเพาะ แอนติบอดีจะส่งสัญญาณให้ระบบภูมิคุ้มกันกำจัดเซลล์เป้าหมาย
โมโนโคลนอลแอนติบอดี (mAbs) เป็นโมเลกุลที่ผลิตขึ้นโดยเทียมซึ่งเลียนแบบแอนติบอดีตามธรรมชาติเหล่านี้ ได้รับการออกแบบมาโดยเฉพาะเพื่อต่อสู้กับเซลล์ที่ไม่ต้องการ เช่น เซลล์มะเร็ง mAbs ทำงานเป็นการรักษาแบบกำหนดเป้าหมาย ระบุตำแหน่งและจับกับโปรตีนจำเพาะที่มีอยู่ในเซลล์มะเร็ง
โมโนโคลนอลแอนติบอดี (mAbs) ต่อสู้กับมะเร็งได้อย่างไร
mAbs ทำงานโดยการจดจำโปรตีนจำเพาะในเซลล์มะเร็ง mAb แต่ละตัวได้รับการปรับแต่งให้จดจำโปรตีนจำเพาะ โดยมี mAbs ต่างๆ ที่ออกแบบมาเพื่อจัดการกับมะเร็งประเภทต่างๆ ขึ้นอยู่กับแอนติเจนเป้าหมาย mAbs เหล่านี้ได้รับการออกแบบมาเพื่อฆ่าเซลล์มะเร็งหรือหยุดการเจริญเติบโต
mAbs สามารถจับกับเซลล์มะเร็งโดยตรงเพื่อฆ่าพวกมันได้ การจับ mAb กับเซลล์เป้าหมายสามารถรับเซลล์เอฟเฟกเตอร์ภูมิคุ้มกัน (เช่น เซลล์เพชฌฆาตตามธรรมชาติ, โมโนไซต์, มาโครฟาจหรือแกรนูโลไซต์) เพื่อทำให้เกิดความเป็นพิษต่อเซลล์ของเซลล์ที่ขึ้นกับแอนติบอดี (ADCC) นอกจากนี้ยังสามารถส่งเสริมการตายของเซลล์ผ่านทางความเป็นพิษต่อเซลล์ที่ขึ้นกับคอมพลิเมนต์ (CDC) ซึ่งการจับ mAb กับเซลล์เป้าหมายส่งผลให้เกิดการกระตุ้นการทำงานของคอมพลีเมนต์คาสเคดที่นำไปสู่การก่อตัวของเมมเบรนโจมตีที่ซับซ้อนบนพื้นผิวของเซลล์
ตัวอย่างหนึ่งคือ rituximab, mAb สำหรับการบำบัดมะเร็งต่อมน้ำเหลืองหรือมะเร็งเม็ดเลือดขาว Rituximab กำหนดเป้าหมายโปรตีน CD20 ที่พบบนพื้นผิวของเซลล์ B เมื่อ rituximab จับกับ CD20 จะกระตุ้นให้ ADCC, CMC และการตายของเซลล์มะเร็งเม็ดเลือดขาวโดยตรง
ยับยั้งการอยู่รอดและการเติบโตของเซลล์มะเร็ง:
mAbs สามารถส่งผลกระทบโดยตรงต่อเซลล์เป้าหมายโดยการป้องกันการจับกันของลิแกนด์ที่กระตุ้นการทำงานที่สำคัญซึ่งมีความสำคัญต่อการอยู่รอดของเซลล์มะเร็ง นอกจากนี้ยังสามารถขัดขวางการลดขนาดตัวรับได้ ดังนั้นจึงยับยั้งสัญญาณกระตุ้นการทำงาน นอกจากนี้ โดยการเชื่อมโยงข้ามรีเซพเตอร์ แอนติบอดีเหล่านี้สามารถเริ่มต้นสัญญาณอะพอพโทติกได้ โดยเฉพาะอย่างยิ่ง mAbs ชอบ ทราสตูซูแมบ และ เพอร์ทูซูแมบ ยกตัวอย่างแนวทางนี้ ทั้งสองกำหนดเป้าหมายไปที่ตัวรับโปรตีน HER2 โดยเฉพาะ ซึ่งมีอยู่ในเซลล์มะเร็งบางชนิด ด้วยการจับกับ HER2 mAbs เหล่านี้จะขัดขวางการเติบโตและการเพิ่มจำนวนของเซลล์มะเร็งที่เป็นบวกของ HER2 ได้อย่างมีประสิทธิภาพ
ยับยั้งการสร้างเส้นเลือดใหม่:
mAbs สามารถทำหน้าที่เป็นตัวยับยั้งการสร้างเส้นเลือดใหม่ ซึ่งเป็นเนื้องอกในกระบวนการที่สำคัญที่ต้องอาศัยการเจริญเติบโต การพัฒนาเนื้องอกจำเป็นต้องมีการสร้างหลอดเลือดใหม่ ซึ่งเป็นกระบวนการที่ขับเคลื่อนโดยปัจจัยที่ทำให้เกิดการสร้างเส้นเลือดใหม่ เช่น ปัจจัยการเจริญเติบโตของหลอดเลือดและผนังหลอดเลือด (VEGF) ซึ่งมะเร็งสร้างขึ้น bevacizumabซึ่งเป็น mAb เฉพาะที่ออกแบบมาเพื่อต่อต้าน VEGF จะหยุดกระบวนการสร้างเส้นเลือดใหม่นี้ได้อย่างมีประสิทธิภาพ การทำเช่นนี้ จะกีดกันเนื้องอกที่กำลังลุกลามของสารอาหารที่จำเป็นและออกซิเจนที่มาจากหลอดเลือดที่เพิ่งสร้างใหม่เหล่านี้ และหยุดการเจริญเติบโตในที่สุด
การปรับปรุงการตอบสนองของทีเซลล์:
mAbs สามารถปรับเปลี่ยนการตอบสนองของทีเซลล์โดยมุ่งเป้าไปที่กลไกการปิดกั้นจุดตรวจภูมิคุ้มกัน ซึ่งขยายปฏิกิริยาของทีเซลล์ต่อต้านเนื้องอก mAbs เหล่านี้มุ่งเน้นไปที่ตัวรับจุดตรวจภูมิคุ้มกันที่อยู่บนพื้นผิวของทีเซลล์ ซึ่งขัดขวางสัญญาณที่โดยปกติจะระงับการกระตุ้นการทำงานของทีเซลล์ ด้วยเหตุนี้ พวกมันจึงเสริมสถานะการกระตุ้นของทีเซลล์ และเพิ่มการทำลายเซลล์เนื้องอกที่ขับเคลื่อนด้วยทีเซลล์ให้รุนแรงขึ้น ภาพประกอบที่สำคัญคือ อิปิลิมูมาบซึ่งเป็น mAb ที่ได้รับการรับรองจาก FDA ซึ่งออกแบบมาสำหรับการรักษามะเร็งผิวหนัง Ipilimumab ยับยั้ง Cytotoxic T lymphocyte-associated antigen 4 (CTLA4) โดยเฉพาะ ซึ่งเป็นตัวรับจุดตรวจที่พบในทีเซลล์ที่ถูกกระตุ้น ด้วยการปิดกั้น CTLA-4 ipilimumab จะเพิ่มการตอบสนองของระบบภูมิคุ้มกันต่อเซลล์มะเร็งผิวหนัง
การนำส่งสารที่เป็นพิษต่อเซลล์:
mAbs บางตัวสามารถปรับแต่งให้ทำหน้าที่เป็นพาหะสำหรับการส่งสารพิษต่อเซลล์ เช่น สารประกอบกัมมันตภาพรังสีหรือยาที่มีศักยภาพไปยังเซลล์มะเร็งโดยเฉพาะ โดยไม่รักษาเซลล์ที่มีสุขภาพดี ตัวอย่างเช่น อิบริตูโมแมบ ทิยูซีแทนซึ่งเป็นการบำบัดด้วยรังสีรักษาที่ได้รับการอนุมัติจาก FDA สำหรับการรักษามะเร็งต่อมน้ำเหลือง โดยจับกับแอนติเจน CD20 บนเซลล์ B การเชื่อมต่อนี้ช่วยให้ไอโซโทปกัมมันตภาพรังสีอิตเทรียม-90 คอนจูเกตกับ mAB เพื่อทำลายเซลล์ด้วยการปล่อยอนุภาคบีตา
ในทำนองเดียวกัน คอนจูเกตของแอนติบอดี-ยา (ADC) ผสานความแม่นยำของ mAbs เข้ากับศักยภาพของสารที่เป็นพิษต่อเซลล์เพื่อกำหนดเป้าหมายเซลล์มะเร็ง เมื่อ mAbs เหล่านี้จับกับเป้าหมายแล้ว ADC จะเข้าสู่เซลล์ ต่อจากนั้น ส่วนประกอบ mAb จะสลายตัว และปล่อยยาที่เป็นพิษต่อเซลล์เพื่อกำจัดเซลล์มะเร็งในขณะที่ยังคงรักษาเซลล์ที่มีสุขภาพดีเอาไว้ ตัวอย่างที่น่าสังเกตก็คือ เบรนตูซิแมบเวโดติน, ใช้สำหรับการรักษามะเร็งต่อมน้ำเหลืองชนิด Hodgkin lymphoma (HL) ที่เกิดซ้ำหรือดื้อยาและมะเร็งต่อมน้ำเหลืองเซลล์ขนาดใหญ่ชนิดอะนาพลาสติกแบบทั่วร่างกาย (ALCL) Brentuximab ให้ความสำคัญกับแอนติเจน CD30 บนเซลล์มะเร็งเป็นศูนย์ โดยส่งสารต้านจุลชีพ monomethyl auristatin E ซึ่งฆ่าเซลล์ได้อย่างมีประสิทธิภาพ
แอนติบอดีที่มีความจำเพาะแบบคู่:
mAbs บางชนิดเอื้อให้เกิดปฏิสัมพันธ์ที่ใกล้ชิดยิ่งขึ้นระหว่างทีเซลล์และเซลล์มะเร็ง โดยช่วยในการกำจัดเซลล์มะเร็งโดยระบบภูมิคุ้มกัน ภาพประกอบที่สำคัญของแนวคิดนี้คือแอนติบอดีที่มีความจำเพาะแบบคู่ mAb ที่ออกแบบเป็นพิเศษนี้ประกอบด้วยส่วนจาก mAbs ที่แตกต่างกัน ซึ่งแต่ละส่วนจับกับแอนติเจนที่แตกต่างกัน ในขณะที่ส่วนหนึ่งจับกับแอนติเจนของเซลล์มะเร็ง ส่วนอีกส่วนหนึ่งจับกับเซลล์ภูมิคุ้มกัน เช่น ทีเซลล์หรือเซลล์ NK เพื่อเชื่อมพวกมันเข้ากับเซลล์มะเร็งและเพิ่มการทำลายล้าง เอ็ปโคริตาแมบ เป็นตัวอย่างที่ดีของแนวทางนี้ โดยเป็นหนึ่งใน mAbs ที่ได้รับการอนุมัติจาก FDA ล่าสุดสำหรับการรักษามะเร็งต่อมน้ำเหลืองบีเซลล์ขนาดใหญ่แบบแพร่กระจาย ออกแบบมาเป็นพิเศษให้เป็นแอนติบอดีที่มีความจำเพาะแบบคู่สำหรับ CD3 และ CD20 โดยจะกระตุ้นการทำงานของเซลล์ที่เป็นพิษต่อเซลล์ที่ขับเคลื่อนด้วย T-cell เพื่อต่อต้าน B-cells ที่เป็นมะเร็งที่เป็นบวกกับ CD20
การบำบัดด้วย CAR-T:
CAR-T บำบัด แสดงถึงแนวทางการบำบัดด้วยภูมิคุ้มกันที่เป็นนวัตกรรมใหม่ โดยควบคุมโมเลกุลที่มีพื้นฐานจากแอนติบอดีเพื่อปรับเปลี่ยนทีลิมโฟไซต์ให้กลายเป็นทีเซลล์ที่เรียกว่าไคเมอริกแอนติเจนรีเซพเตอร์ (CAR) เซลล์ CAR-T ที่ได้รับการดัดแปลงพันธุกรรมเหล่านี้ได้รับการออกแบบมาเพื่อจดจำแอนติเจนที่จำเพาะในเซลล์เป้าหมาย พวกมันรวมเอาบริเวณที่แปรผันได้ของมอนอโคลนอลแอนติบอดีสายเดี่ยวที่ระบุเป้าหมาย ควบคู่กับการเปิดใช้งานโดเมนทรานส์เมมเบรนที่กระตุ้นทีเซลล์เมื่อพบกับเซลล์เป้าหมาย โดยเฉพาะอย่างยิ่ง แอนติเจนจำนวนมากที่ถูกกำหนดเป้าหมายโดย mAbs ก่อนหน้านี้ได้รับการแก้ไขแล้วโดยใช้เซลล์ CAR-T ตัวอย่างที่บุกเบิกคือ Tisagenlecleucel (Kymriah) ซึ่งเป็นการบำบัดด้วยเซลล์ CAR-T ที่ได้รับการอนุมัติจาก FDA โดยมีเป้าหมายไปที่ CD19 ในการรักษามะเร็งเม็ดเลือดขาวชนิดเฉียบพลันชนิดลิมโฟบลาสติกชนิด B-cell (ALL) ปัจจุบัน FDA ได้ไฟเขียวการรักษาเซลล์ CAR-T จำนวน XNUMX วิธีสำหรับมะเร็งทางโลหิตวิทยาต่างๆ
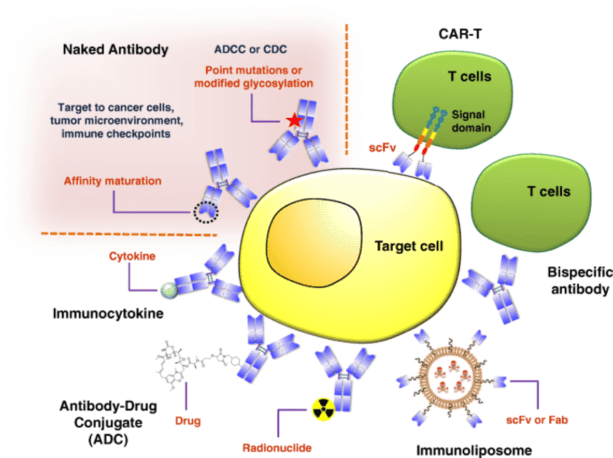 ภาพรวมของการบำบัดโดยใช้แอนติบอดีสำหรับการรักษามะเร็ง
ภาพรวมของการบำบัดโดยใช้แอนติบอดีสำหรับการรักษามะเร็ง
เครดิต: Jin, S. , Sun, Y. , Liang, X. และคณะ doi.org/10.1038/s41392-021-00868-x.
ทำซ้ำภายใต้ สัญญาอนุญาตครีเอทีฟคอมมอนส์
โมโนโคลนอลแอนติบอดี (mAbs) ที่ได้รับอนุมัติ
mAbs กำลังเกิดขึ้นอย่างรวดเร็วในฐานะโดเมนชั้นนำในด้านนวัตกรรมทางเภสัชกรรม โดยคาดว่าจะแพร่หลายมากขึ้นในทศวรรษหน้า ด้านล่างนี้ คุณจะพบตารางสรุปที่เน้นการบำบัดด้วยแอนติบอดีที่ได้รับอนุมัติสำหรับการรักษาโรคมะเร็งในสหภาพยุโรป (EU) และสหรัฐอเมริกา (US)
| INN | ชื่อยี่ห้อ | เป้า; รูปแบบ | 1st บ่งชี้ได้รับการอนุมัติ | 1st ปีที่อนุมัติของสหภาพยุโรป / สหรัฐอเมริกา |
| เอ็ปโคริตาแมบ | เอพคินลี่™ | ซีดี20, ซีดี3; IgG1 ที่ทำให้มีลักษณะของมนุษย์แบบที่มีความจำเพาะแบบคู่ | มะเร็งต่อมน้ำเหลือง B เซลล์ขนาดใหญ่กระจาย | 2023 / 2023 |
| นิโวลูแมบ | ออปดิโว | พีดี1; IgG4 ของมนุษย์ | Melanoma มะเร็งปอดชนิดไม่ใช่เซลล์ขนาดเล็ก | 2015 / 2014 |
| โอบินุตูซูแมบ | กาซีวา | ซีดี20; IgG1 ที่ทำให้มีลักษณะของมนุษย์; ไกลโคเอ็นจิเนียริ่ง | มะเร็งเม็ดเลือดขาวชนิด lymphocytic เรื้อรัง | 2014 / 2013 |
| เปอร์ทูซูแมบ | เปอร์เจตา | เธอ2; IgG1 ที่ทำให้มีลักษณะของมนุษย์ | โรคมะเร็งเต้านม | 2013 / 2012 |
| เบรนตูซิแมบเวโดติน | โฆษณา | ซีดี30; คิเมริก IgG1, ADC | มะเร็งต่อมน้ำเหลือง Hodgkin, มะเร็งต่อมน้ำเหลืองเซลล์ขนาดใหญ่แบบ anaplastic | 2012 / 2011 |
| อิปิลิมูมาบ | เยอร์วอย | CTLA-4; IgG1 ของมนุษย์ | มะเร็งผิวหนังระยะแพร่กระจาย | 2011 / 2011 |
| bevacizumab | Avastin | วีจีเอฟ; IgG1 ที่ทำให้มีลักษณะของมนุษย์ | มะเร็งลำไส้ใหญ่และทวารหนัก | 2005 / 2004 |
| อิบริทูมาแมบ ไทเซตัน | เซวาลิน | ซีดี20; มูรีน IgG1 | มะเร็งต่อมน้ำเหลืองชนิด Non-Hodgkin | 2004 / 2002 |
| trastuzumab | เฮอร์เซปติน | เธอ2; IgG1 ที่ทำให้มีลักษณะของมนุษย์ | โรคมะเร็งเต้านม | 2000 / 1998 |
| rituximab | มาบเถระ, ริทักซาน | ซีดี20; คิเมริก IgG1 | มะเร็งต่อมน้ำเหลืองชนิด Non-Hodgkin | 1998 / 1997 |
ข้อมูลที่ได้รับจาก: The Antibody Society โมโนโคลนอลแอนติบอดีสำหรับการรักษาโรคได้รับการอนุมัติหรืออยู่ระหว่างการทบทวนในสหภาพยุโรปหรือสหรัฐอเมริกา (วันที่เข้าถึง – 28 ธ.ค. 2023); www.antibodysociety.org/resources/approved-antibodies
อ้างอิง:
Chen YJ, Abila B, Mostafa Kamel Y. CAR-T: อะไรต่อไป? มะเร็ง (บาเซิล) 2023 ม.ค. 21;15(3):663. ดอย: 10.3390/cancers15030663.
Jin, S. , Sun, Y. , Liang, X. และคณะ อนุพันธ์ของแอนติบอดีรักษาโรคชนิดใหม่สำหรับการรักษาโรคมะเร็ง Sig Transduct Target Ther 7, 39 (2022) https://doi.org/10.1038/s41392-021-00868-x
ลู, RM., ฮวาง, YC., หลิว, ไอเจ. และคณะ การพัฒนาแอนติบอดีรักษาโรคสำหรับการรักษาโรค เจ ชีวการแพทย์ 27, 1 (2020) https://doi.org/10.1186/s12929-019-0592-z
ไวเนอร์ จีเจ. การสร้างการบำบัดโดยใช้โมโนโคลนอลแอนติบอดีที่ดีขึ้น แนท เรฟ มะเร็ง. 2015;15(6):361-370. ดอย:10.1038/nrc3930
Zahavi D, Weiner L. โมโนโคลนอลแอนติบอดีในการรักษาโรคมะเร็ง แอนติบอดี (บาเซิล) 2020 ก.ค. 20;9(3):34. ดอย: 10.3390/antib9030034









