BE-梯度: 是我们设计用于将电化学梯度应用于 3D 细胞培养的设备。 BE-Gradient 与任何类型的光学显微镜(倒相差、共焦、荧光……)兼容。 Be-Gradient 由一个用于细胞培养的中央室和两个通过 3 个小微通道连接到中央室的侧向通道组成。 横向通道旨在模拟血管。 不仅在中央室而且在横向通道中的贴壁细胞也可以进行二维培养。
文化模式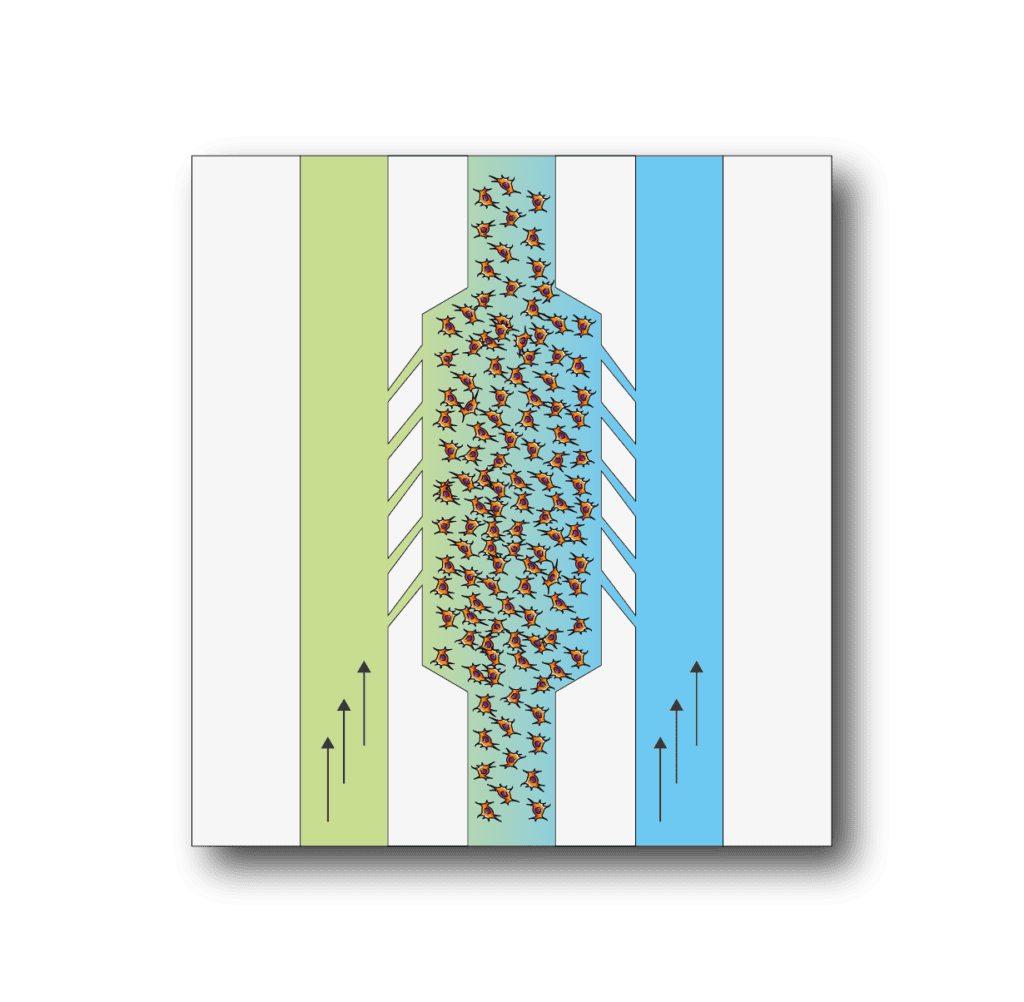
对您的 3D 细胞培养应用电化学梯度。 首先将您的细胞混合在液态水凝胶中,然后将它们接种到中央室中。 水凝胶聚合完成后,通过横向通道向培养基中灌注不同浓度的化合物,并实时监测效果。
应用领域
BE-Gradient 是一种芯片,在设计时考虑到了非常特殊的功能,用于研究电化学梯度下的培养物。 该设备允许进行永远无法在培养皿中进行的实验,例如营养、氧气或药物梯度的应用、这些条件下细胞迁移的研究、血管生成研究等等。
应用实例
趋化迁移研究:视频显示嵌入胶原蛋白并引入微室的多细胞球体。 通过将含有血清的生长培养基添加到其中一个侧通道中,在整个中央室建立了胎牛血清 (FBS) 的梯度。 我们观察到口腔鳞状癌细胞 OSC-19 的球体沿胎牛血清梯度方向集体侵入。 这种入侵比在同一实验装置中观察到的单个细胞更具方向性和侵略性。 与 OSC-19 的球状体相反,U87-MG 多细胞球状体作为单个细胞迁移。 对球体暴露于趋化剂的研究表明,扩散到球体中的速度很慢,因此,趋化波在通过球体扩散之前吞没了球体。 对整个微室的趋化梯度的控制,加上随着时间的推移观察和密切监测系统的能力,使 BE-Gradient 成为研究趋化过程的强大技术。 近年来,集体入侵被认为是上皮肿瘤发展过程中的主要迁移模式。 使用 BE-Gradient 可以观察和分析该过程 细胞/组织.
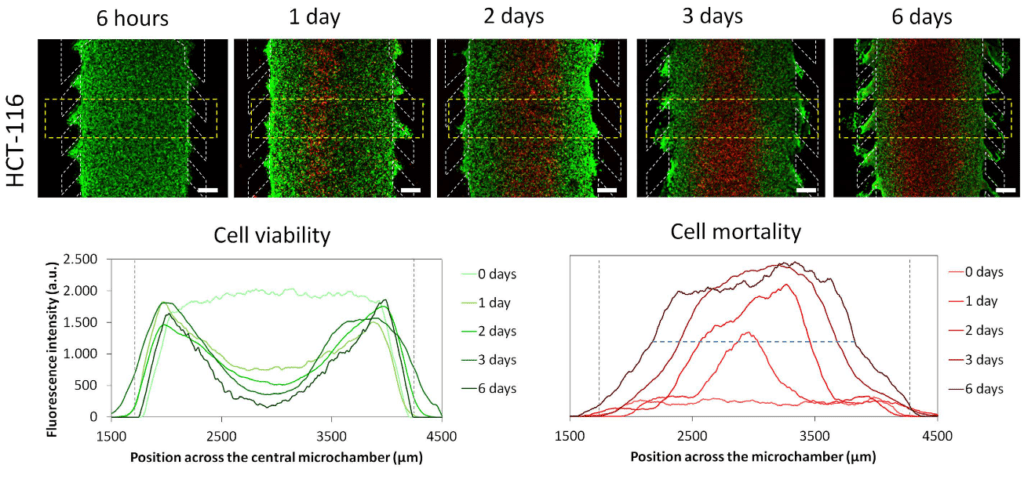
微型设备内的坏死核心生成: HCT-116 细胞被包埋在中央微室的胶原水凝胶中。 40 万个 HCT-116 细胞/ml 被限制在中央微室中,并在指定时间使用钙黄绿素 (CAM) 将活细胞染成绿色并使用碘化丙锭 (PI) 将死细胞染成红色来评估细胞活力。 图表显示沿图像中分隔区域的 CAM 或 PI 荧光强度分布。 柱子的位置由灰色虚线界定。 6 天后坏死核心的宽度被测量为微室中达到最大 PI 荧光强度(蓝色虚线水平线)50% 的那些位置之间的距离。 坏死核心宽度为 1643 ± 9 μM,p 值 < 0.05。 比例尺为 400 μm。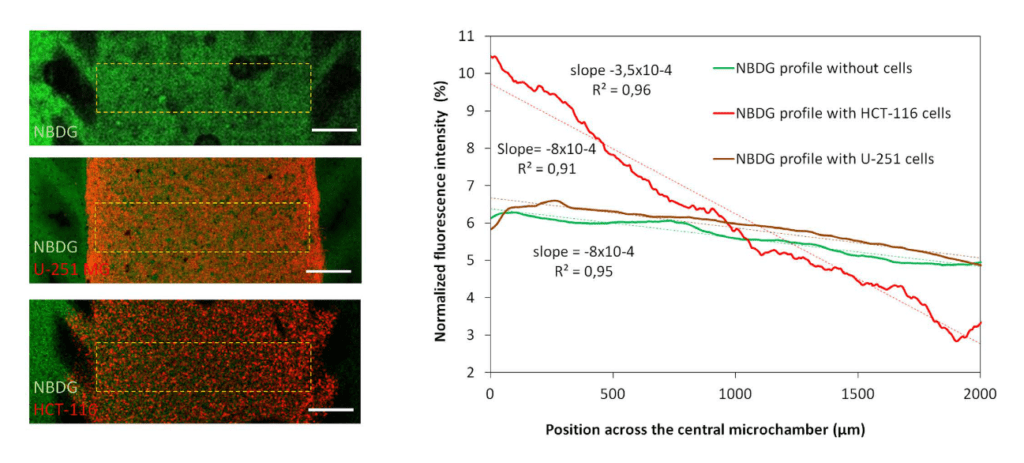
葡萄糖梯度:通过左侧微通道灌注绿色荧光葡萄糖类似物(NBDG,200 μ M),并在细胞存在或不存在的情况下研究扩散曲线。 该图显示了 90 分钟后 NBDG 在中央微室中的扩散曲线,表明 NBDG 能够穿透胶原蛋白水凝胶。 在没有细胞或存在 HCT-116 或 U-251 MG 细胞的情况下计算扩散曲线斜率。 比例尺为 400 μm。
设备特点
- 易于使用:Be-Gradient 与任何类型的光学显微镜(共聚焦、荧光……)兼容,其载玻片格式已被选择为易于在显微镜下操作。
- 易于实施:Be-Gradient 室位于 96 孔板的标准位置,用于自动显微镜。
- 易于连接:Be-Gradient 与所有微流体流量控制系统(注射器、蠕动泵、压力控制系统、摇杆系统……)兼容。
- 无非特异性吸收:与其他 PDMS 设备不同,Be-Gradientis 由疏脂热塑性材料制成,不会出现非特异性药物吸收问题。 因此,它允许使用荧光检测进行免疫组织化学。
- 细胞回收选项:Be-Gradient 中使用的细胞培养物可以轻松回收用于进一步实验