- 您的购物车是空的
- 继续购物
在以下趋势的推动下,癌症治疗领域正在经历变革:iPSC 衍生的 MSC、MSC 衍生的 EV 以及 Cas9 介导的 MSC 基因编辑。 iPSC 衍生的 MSC 提供了可扩展且标准化的细胞来源,克服了与传统收获方法相关的限制。 MSC 衍生的 EV 成为一种有前景的无细胞治疗工具,具有靶向药物输送能力和较低的免疫原性。同时,Cas9介导的基因编辑能够精确控制间充质干细胞的行为,提高其治疗效率。这些创新共同推动了该领域的发展,为个性化、有效和更安全的癌症治疗开辟了途径。 StemCell Express 真正走上了进步的轨道,为抗击癌症的光明未来带来了希望。
干细胞已成为癌症治疗基因和细胞疗法不断发展的关键参与者,具有解决这种疾病复杂性的巨大潜力。各种干细胞,包括造血干细胞(HSC)、诱导多能干细胞(iPSC)和间充质基质/干细胞(MSC)已被用于细胞治疗,并取得了可喜的结果。这些多功能细胞可用于传递治疗基因,提供有针对性的精确方法来对抗肿瘤。此外,干细胞表现出独特的特性,包括调节免疫系统的能力,使它们成为增强人体对癌症的自然防御能力的宝贵资产。
在各种干细胞类型中,间充质干细胞是特别有前途的候选细胞。间充质干细胞可进行工程设计并能够归巢到肿瘤部位,具有双重优势:提供治疗有效载荷并促进针对癌细胞的免疫反应。将间充质干细胞整合到基因和细胞治疗策略中,有可能重塑癌症治疗范式,为患者提供新颖的个性化解决方案。
通过这一系列 Stem Cell Express 了解使用 MSC 进行癌症治疗的最新趋势和进展。
目前临床试验中使用的间充质干细胞主要通过侵入性操作从脂肪组织、脐带或骨髓中获取。间充质干细胞的扩增能力有限,需要重复的分离程序才能满足细胞治疗的需求,加上与此相关的高成本 细胞/组织 扩展,限制了它们的临床可及性和广泛采用。传统方法的特点是增殖潜力有限和供体之间存在差异,导致临床试验结果不一致。
确定适当的供体来源或探索 MSC 生产的替代方法对于解决阻碍大规模 MSC 生产的现有瓶颈至关重要。
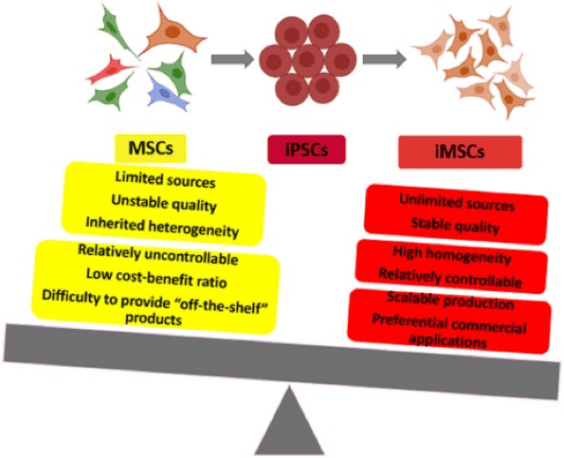
iPSC 代表了再生医学的革命性进步,提供了产生用于治疗目的的各种细胞类型的潜力。 iPSC 具有高度的自我更新能力、增殖能力以及向中胚层、内胚层和外胚层分化的能力,绕过了与胚胎干细胞 (ESC) 相关的伦理问题。在 iPSC 可以产生的各种细胞谱系中,MSC 是一个特别有价值的细胞群。
使用 iPSC 衍生的 MSC 的优势在于克服了从成体组织中收获 MSC 的局限性,包括侵入性操作和有限的细胞产量。 iPSC 衍生的 MSC 可以大量生成,提供一致且可扩展的细胞来源。此外,这些细胞可以潜在地解决与供体变异性和年龄相关变化相关的问题,从而提供更加标准化和可靠的细胞产品。 iPSC 的多能起源增强了其治疗应用的可扩展性和可重复性。值得注意的是,iPSC 来源的 MSC 在形态、免疫表型和三谱系分化能力方面与组织来源的 MSC 非常相似,同时在动物疾病模型中表现出更强的再生能力。
2017年,Cynata Therapeutics进行了全球首个同种异体iPSC衍生细胞产品的正式1期试验(编号NCT02923375) (CYP-001) 患有类固醇抗性(SR)急性移植物抗宿主病(aGVHD)的成人。该试验表明,在有限数量的 SR-aGVHD 受试者中,CYP-001 是安全且可耐受的。尽管需要进行更大样本量的进一步试验来确认疗效,但观察到的 aGvHD 反应令人鼓舞,为利用 iPSC 衍生的 MSC 治疗各种疾病铺平了道路。总之,该试验的令人鼓舞的结果表明,iPSC 衍生的 MSC 不仅在治疗类固醇耐药的急性移植物抗宿主病(SR-aGVHD)方面表现出安全性和耐受性,而且还为其在癌症治疗中的应用开辟了新的视野。 iPSC 衍生的 MSC 具有大规模生产稳定且可持续的“现成”产品的潜力,是解决免疫性疾病和癌症治疗中复杂挑战的多功能且令人鼓舞的资源。
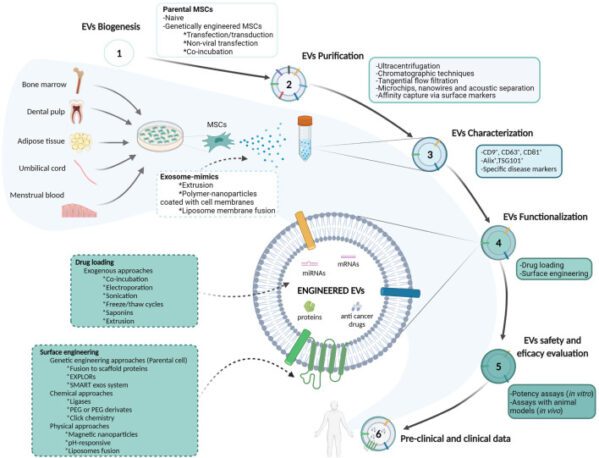
近年来,源自间充质干细胞的细胞外囊泡(EV)已成为一种有前景的药物递送平台,利用其固有的生物相容性和靶向递送能力,将其与脂质体等人造纳米载体区分开来。研究表明,MSC 的许多旁分泌功能,包括生长因子、细胞因子、趋化因子和 EV 的释放,有助于其治疗效果。
EV 可以根据大小进行分类:外泌体 (30-150 nm)、微泡 (150-500 nm) 和凋亡小体 (800-500 nm)。 MSC 衍生的 EV 反映了 MSC 的生物潜力,为 MSC 细胞疗法提供了更安全的替代方案,后者可能容易受到肺微脉管系统中遗传或表型变化和聚集的影响。
MSC-EV出于这些原因,为实现无细胞疗法提供了一个有趣的选择,特别是其在癌症治疗中的潜力而引人注目。除了其固有的和特定目标的归巢能力之外,MSC-EV 还可以保护生物货物(包括 miRNA 和 mRNA)免遭降解 体内。此外,与MSC相比,MSC-EV表现出较低的免疫原性,并且可以进行基因改造以提高组织靶向效率,作为抗癌药物和生物制剂的有效载体,从而克服癌症治疗中的耐药性。
探索 MSC-EV 的临床试验涵盖多种适应症,例如 COVID-19、糖尿病、阿尔茨海默病,尤其是癌症治疗。第一阶段试验(NCT03608631)目前正在针对胰腺癌中的 KRAS G12D 突变进行治疗。 KRAS G12D 是胰腺癌中的一种常见突变,是专门针对这种突变的治疗的重点。研究人员正在评估携带 KrasG12D siRNA 的 MSC-EV 在转移性胰腺癌患者中的安全性和合适剂量。
尽管 MSC-EV 有望成为临床癌症治疗的新型无细胞治疗工具,但挑战仍然存在。用于异构 MSC-EV 的隔离和表征的标准化协议势在必行。由于已记录的促肿瘤特性、其他细胞的内化以及巨噬细胞的清除,安全性和有效性问题引起了人们的关注。天然 MSC-EV 的产量低及其在药物输送方面的有限功效强调需要进一步的临床前和临床研究,以推动 MSC-EV 疗法进入广泛的临床应用。
尽管间充质干细胞因其固有的优势和有益特性而受到广泛关注,但完整形式的间充质干细胞的应用存在一定的局限性。间充质干细胞可能无法有效地导航到特定的靶组织或肿瘤,从而限制了它们将治疗剂精确递送到作用部位的能力。此外,这些细胞在给药后在体内的持续时间可能有限,需要重复剂量才能获得持续的治疗效果。人们还担心间充质干细胞在完整施用时有可能分化成非预期的细胞类型或表现出不可预测的行为 体内,强调需要精确控制自己的行为。
为了克服这些挑战,建议采用多种方法通过基因改造来提高 MSC 效率。为此目的,采用了多种技术,包括病毒载体(慢病毒载体/腺病毒载体)、质粒转染、电穿孔、转座子、纳米颗粒介导的递送和革命性的CRISPR/Cas9技术。
在这些方法中,CRISPR/Cas9作为一种高效的基因编辑工具脱颖而出,被科学界广泛接受。其首次临床应用 批准 在英国,用于治疗镰状细胞病和输血依赖性β地中海贫血(TDT)的药物为解决一系列疾病铺平了道路。在癌症治疗中,CRISPR/Cas9 在基因工程免疫细胞(尤其是 T 细胞)方面越来越受到重视,以增强其对抗肿瘤的有效性。
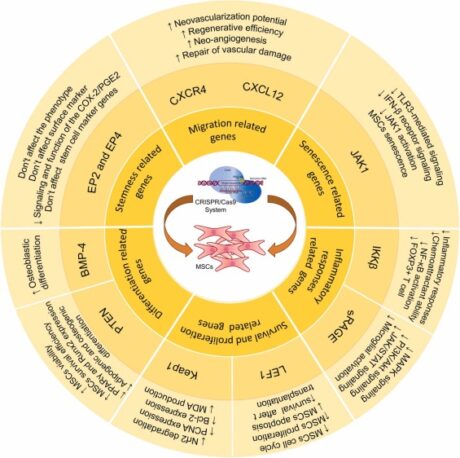
CRISPR/Cas9 的显着特征之一是它能够同时靶向多个基因序列,这使其成为与其他基因编辑技术相比更具成本效益的选择。 CRISPR/Cas9编辑的MSCs的应用是多种多样的,包括保留MSC干性、减少MSC衰老和细胞凋亡、以及增强MSC存活和免疫调节特性。每一项修改的战略目的都是为了提高 MSC 的治疗效率。图 9 总结了 CRISPR/Cas3 工程对 MSCs 研究的结果,突显了这种基因编辑工具在提高 MSCs 治疗能力方面的变革潜力。
参考资料
Abdal Dayem A、Lee SB、Kim K、Lim KM、Jeon TI、Seok J、Cho AS。通过干细胞重编程生产间充质干细胞。国际分子科学杂志。 2019 年 18 月 20 日;8(1922):10.3390。 doi:20081922/ijms31003536。电话号码:6514654; PMCID:PMCXNUMX。
Bloor AJC、Patel A、Griffin JE 等人。 iPSC 来源的间充质基质细胞在急性类固醇抗性移植物抗宿主疾病中的生产、安全性和功效:一项 I 期、多中心、开放标签、剂量递增研究。纳特医学。 2020;26(11):1720-1725。 doi:10.1038/s41591-020-1050-x
Dalmizrak A, Dalmizrak O. 间充质干细胞衍生的外泌体作为在癌症治疗中递送 miRNA 的新工具。 前沿生物工程生物技术。 2022;10:956563。发布于 2022 年 26 月 10.3389 日。doi:2022.956563/fbioe.XNUMX
Golchin A、Shams F、Karami F。利用 CRISPR/Cas9 推进间充质干细胞治疗的临床试验研究。高级实验医学生物学。 2020;1247:89-100。 doi:10.1007/5584_2019_459
Hazrati A、Malekpour K、Soudi S、Hashemi SM。 CRISPR/Cas9 工程改造的间充质基质/干细胞及其细胞外囊泡:克服细胞治疗局限性的新方法。生物医学药剂师。 2022;156:113943。 doi:10.1016/j.biopha.2022.113943
Lotfy A,AboQuella NM,Wang H。临床试验中的间充质基质/干细胞(MSC)衍生的外泌体。干细胞研究。 2023;14(1):66。 2023 年 7 月 10.1186 日发布。doi:13287/s023-03287-7-XNUMX
Phelps J、Sanati-Nezhad A、Ungrin M、Duncan NA、Sen A。间充质干细胞及其衍生物的生物加工:走向无细胞治疗。 干细胞国际。 2018;2018:9415367。发布于 2018 年 12 月 10.1155 日。doi:2018/9415367/XNUMX
Sanmartin MC、Borzone FR、Giorello MB、Yannarelli G、Chasseling NA。间充质基质细胞衍生的细胞外囊泡作为癌症治疗中药物输送的生物载体。 前沿生物工程生物技术。 2022;10:882545。发布于 2022 年 14 月 10.3389 日。doi:2022.882545/fbioe.XNUMX
Shan C,Liang Y,Wang K,Li P。间充质干细胞衍生的细胞外囊泡在癌症治疗抵抗中的作用:从生物学到临床机会。国际生物科学杂志。 2024;20(1):347-366。 2024 年 1 月 10.7150 日发布。doi:88500/ijbs.XNUMX
张杰,陈明,廖杰,等。诱导多能干细胞衍生的间充质干细胞异质性较低,在生物学研究和临床应用中具有广阔的前景。 前细胞发育生物学。 2021;9:716907。发布于 2021 年 30 月 10.3389 日。doi:2021.716907/fcell.XNUMX


探索为什么 FBS 可追溯性在癌症研究中至关重要。了解 ISIA 认证和值得信赖的血清产品,以获得可靠的结果。