- 您的购物车是空的
- 继续购物


间充质干细胞 (MSC) 是成体多能细胞,已被证明具有非凡的抗癌特性,使其成为癌症治疗的独特选择。 研究人员目前正在探索将 MSCs 用于癌症治疗的新方法,例如将抗癌药物加载到它们中,或改造 MSCs 以运输药物化合物。 然而,值得注意的是,MSCs 在癌症治疗中的作用存在争议,应该予以考虑。
大多数抗癌药物可以被 MSCs 从其培养环境中摄取,使其成为潜在的 运药车 在癌症治疗中。 这导致了药物启动 MSCs 的简单方法的发展,例如将它们与紫杉醇、吉西他滨或索拉非尼等药物一起孵育,这些药物已被证明能被 MSCs 有效吸收。 然而,应该注意的是,药物吸收到 MSCs 的途径可能因药物类型而异。 一些药物通过转运蛋白被吸收,而其他药物则依靠简单的扩散或内吞作用。 这突出了了解不同药物被 MSC 吸收的具体机制的重要性,因为这会影响它们作为癌症治疗中的药物输送载体的有效性。
已用于生产用于癌症治疗的精准药物的 MSC 最重要的治疗机制之一是其肿瘤归巢能力。 这种特性允许将多种抗癌药物靶向递送至肿瘤部位。 到达肿瘤后,MSCs 能够以时间依赖的方式释放抗癌药物。 药物释放的有效性取决于细胞类型和药物类型。 例如,研究表明载药人骨髓间充质干细胞 (hBM-MSCs) 在 1 小时后开始以 2 pg/细胞的速率释放紫杉醇,1.7 小时后增加到 2.0-144 pg/细胞。 另一方面,脂肪组织来源的 MSCs (AD-MSCs) 被发现在前 48 小时内释放大部分紫杉醇,在随后的 144 小时内仅释放少量紫杉醇。
MSCs 选择性靶向肿瘤并以受控方式释放药物的能力为开发更有效和精确的癌症治疗带来了重大希望。
MSC 有潜力成为 被基因工程处理过 表达或分泌一系列可以抑制癌症生长和进展的化学物质。 使用基因工程 MSC 可以递送三类药物:治疗性蛋白质、自杀基因和溶瘤病毒。
首先,许多研究都提出了治疗性蛋白质的递送。 治疗性蛋白质,如生长因子、细胞因子、干扰素和转录因子,可由 MSC 递送以抑制肿瘤生长或作为促肿瘤因子的抑制剂发挥作用。 一种这样的细胞因子是 IL-12,它可以增加 T 细胞和细胞毒性 NK 细胞的活化。 研究表明,表达 IL-12 的 MSC 可以减少肾细胞癌和宫颈肿瘤小鼠模型中的肿瘤生长。 IFN-β 等干扰素与肿瘤特异性抗体或标准化疗药物联合使用已被证明可有效限制小鼠模型中的癌症进展。 转录因子在许多研究中也被证明是有益的。 例如,表达促凋亡蛋白肿瘤坏死因子相关凋亡诱导配体 (TRAIL) 的 MSC 已被证明可促进多种恶性肿瘤(包括肺癌、乳腺癌、脑癌、宫颈癌和结直肠癌)中肿瘤细胞的凋亡.
其次,MSCs 已经过基因改造以表达能够将无害试剂转化为有毒抗癌药物的自杀基因。 这种方法基于这样的原理,即转基因 MSC 可以在肿瘤附近将前药转化为活性形式,从而选择性地杀死癌细胞。 几种酶-前药系统已用于各种类型的肿瘤,包括与更昔洛韦复合的单纯疱疹病毒胸苷激酶(HSV-TK/GCV 系统)、CD 与 5-氟胞嘧啶(5-FC)、CE 与伊立替康(CPT- 11), 和细胞色素 P450 与环磷酰胺或异环磷酰胺。 例如,携带“自杀基因”胞嘧啶脱氨酶::尿嘧啶磷酸核糖转移酶 (CD::UPRT) 的 MSC 可有效减少肿瘤生长。 CD::UPRT 具有将无毒药物 5-氟胞嘧啶转化为有毒抗肿瘤剂 5-氟尿嘧啶的能力,已被证明在结肠癌和黑色素瘤小鼠模型中有效。
最后,溶瘤病毒 (OV) 可以通过表面蛋白识别和粘附癌细胞,从而选择性地杀死癌细胞,从而导致溶瘤。 有多种 OV 可用,包括腺病毒、疱疹病毒、麻疹病毒、柯萨奇病毒、脊髓灰质炎病毒、呼肠孤病毒、痘病毒和新城疫病毒。 例如,溶瘤单纯疱疹病毒 1 已被证明可以通过减少抗炎巨噬细胞的比例和增加肿瘤浸润淋巴细胞的比例来改变肿瘤微环境 (TME)。 然而,直接 OV 递送的功效通常是有限的,因为宿主的防御机制可以去除外源病毒。 因此,MSC 被用作运输和保护 OV 的载体。
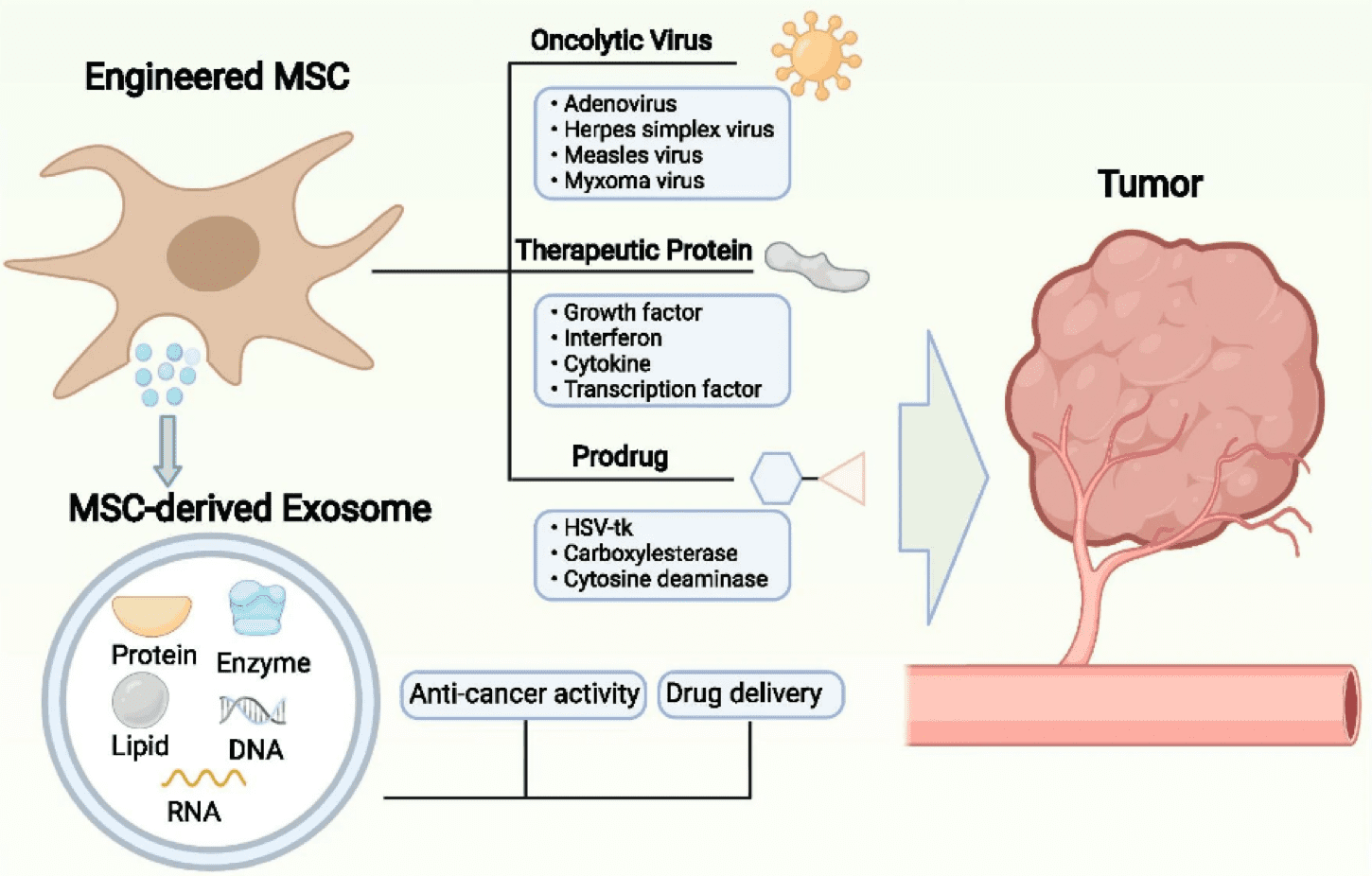
Credit: Lan T, Luo M, Wei X doi:10.1186/s13045-021-01208-w 转载于 知识共享许可
MSCs 的免疫调节特性是通过直接的细胞间相互作用或可溶性物质的旁分泌释放来介导的。 然而,有几个 有争议的 MSC 角色 应该提到这一点,特别是关于它们对癌症进展的影响。
一方面,MSCs 可能以多种方式在癌症的形成和进展中发挥作用。 例如,MSCs 可以通过释放 CCL5 等物质影响肿瘤细胞的表型,从而促进转移性乳腺癌细胞的侵袭性。 此外,MSCs 通过上调乳腺癌和前列腺恶性肿瘤 TME 内 VEGF 和 IL-6 的表达水平与肿瘤血管生成相关联,从而导致肿瘤血管化增加。 此外,为了响应癌细胞产生的可溶性物质,例如 TGF-1,MSC 可能会发育成癌症相关的成纤维细胞 (CAF)。 最后,除了通过可溶性信号分子显示促肿瘤特征外,MSC 还可以通过细胞间接触或细胞吞噬直接促进肿瘤发展。
另一方面,大量研究发现MSCs通过MSCs对肿瘤细胞的细胞毒性抑制肿瘤的发生发展。 例如,之前的研究表明,MSCs 通过 PI3K/AKT 通路引起细胞凋亡并减少神经胶质瘤细胞增殖。 此外,细胞间接触导致 MSC 在 G0/G1 期停止淋巴癌的细胞周期。
MSCs 抑制或增加癌症形成的能力可能受到动物模型、细胞系、剂量和治疗持续时间等实验条件差异的影响。 因此,有必要进行进一步的体内研究以系统地研究 MSC 的这些作用。
总而言之,虽然有许多使用载药或基因工程 MSC 治疗癌症的有前途的方法,但也有几个必须解决的潜在问题。 首先,肿瘤细胞根除后残留的修饰 MSCs 可能会产生不可预见的问题。 其次,MSCs 递送的治疗性蛋白质可能会影响 MSCs 增殖并增加畸胎瘤形成的机会。 第三,MSC 肿瘤归巢的功效可能会因归巢分子表达不足而受到影响,这可能会导致脱靶问题。 因此,研究人员有很大的机会继续完善基于 MSC 的癌症治疗技术,以最大限度地减少这些担忧并最大限度地发挥其治疗潜力。
Babajani A、Soltani P、Jamshidi E、Farjoo MH、Niknejad H. 载药间充质干细胞与抗肿瘤药物靶向治疗癌症的最新进展。 Front Bioeng Biotechnol。 2020;8:748。
Harrell CR、Volarevic A、Djonov VG、Jovicic N、Volarevic V. 间充质干细胞:抗肿瘤免疫力中的敌友。 Int J Mol Sci。 2021;22(22):12429。
Hemminki O、Dos Santos JM、Hemminki A. 用于癌症免疫治疗的溶瘤病毒。 J Hematol Oncol。 2020;13(1):84。
Lan T、Luo M、Wei X. 癌症治疗中的间充质干/基质细胞。 J Hematol Oncol。 2021;14(1):195。
Liang W, Chen X, Zhang S, 等人。 间充质干细胞作为肿瘤生长中的双刃剑:关注 MSC 衍生的细胞因子。 细胞分子生物学快报。 2021;26(1):3。
Marofi F、Vahedi G、Biglari A、Esmaeilzadeh A、Athari SS。 间充质基质/干细胞:基于细胞的癌症靶向基因治疗的新时代。 前免疫。 2017;8:1770。


了解细胞治疗初创公司如何利用关键工艺参数 (CPP) 来确保产品质量、有效扩展规模并满足监管标准。
