- 您的购物车是空的
- 继续购物

CRISPR-Cas9 基因编辑 CRISPR技术彻底改变了生物医学研究,为DNA修饰提供了前所未有的精准度。然而,如何高效安全地将CRISPR组件递送至靶细胞仍然是一个重大挑战。 腺相关病毒(AAV) 由于其安全性、组织特异性和长期基因表达,已成为领先的运载工具。
CRISPR-Cas9 是一种突破性的基因编辑工具,最初源自细菌的天然免疫防御系统。它因其 精确, 效率汽车保险理赔及 多功能性.
CRISPR-Cas9 是一个双组分系统:
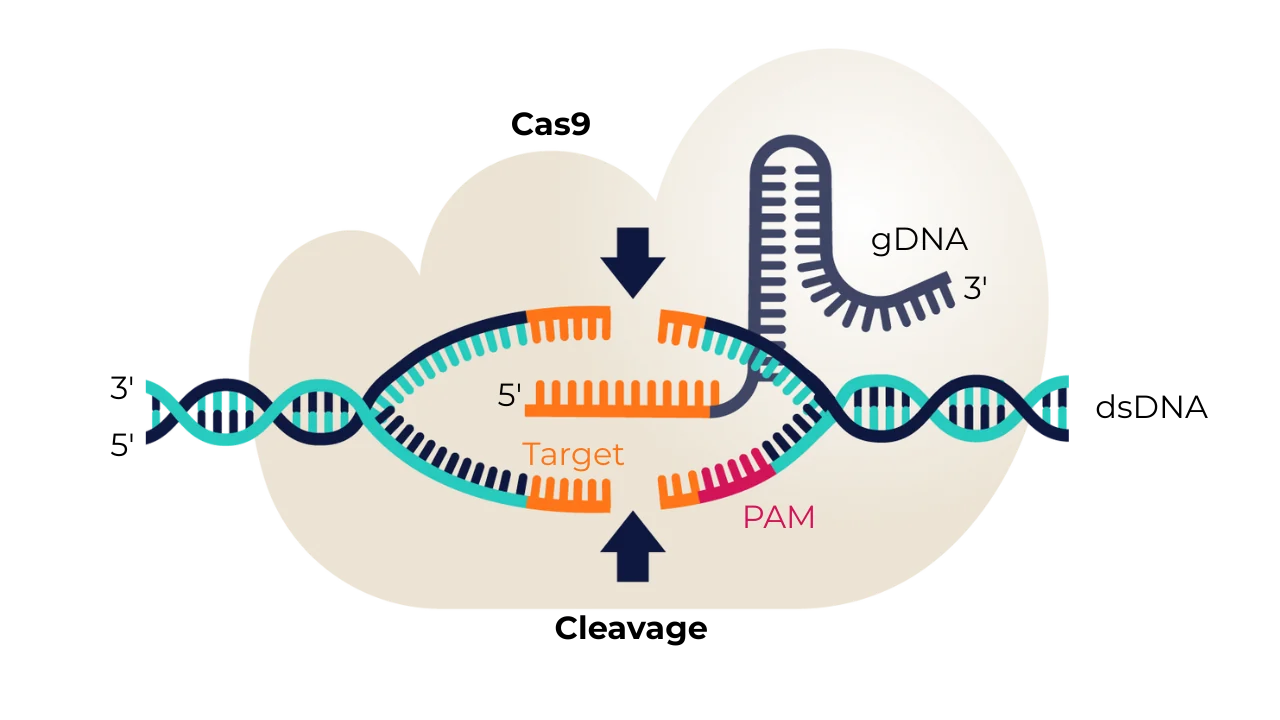
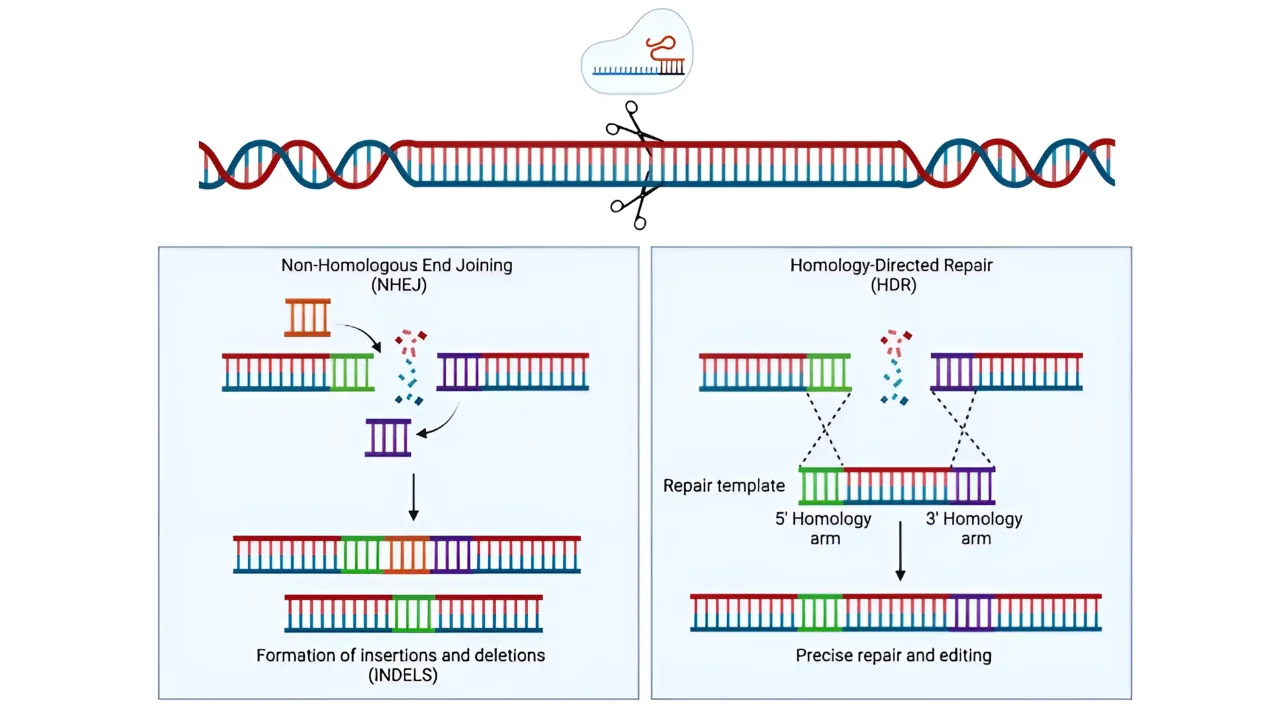
Cas9 切割 DNA 后,细胞会将断裂检测为损伤,并迅速启动其天然修复系统。修复途径的选择决定了 DNA 是被简单地修补错误,还是被精确地改写,这对于基因组编辑的结果至关重要。
1.非同源末端连接(NHEJ)
2. 同源性定向修复(HDR)
高效地将 CRISPR 组件递送至细胞对于基因组编辑的成功至关重要。在众多递送方法中,AAV 已成为一种热门选择。
AAV 非常适合 CRISPR 递送,因为它们:
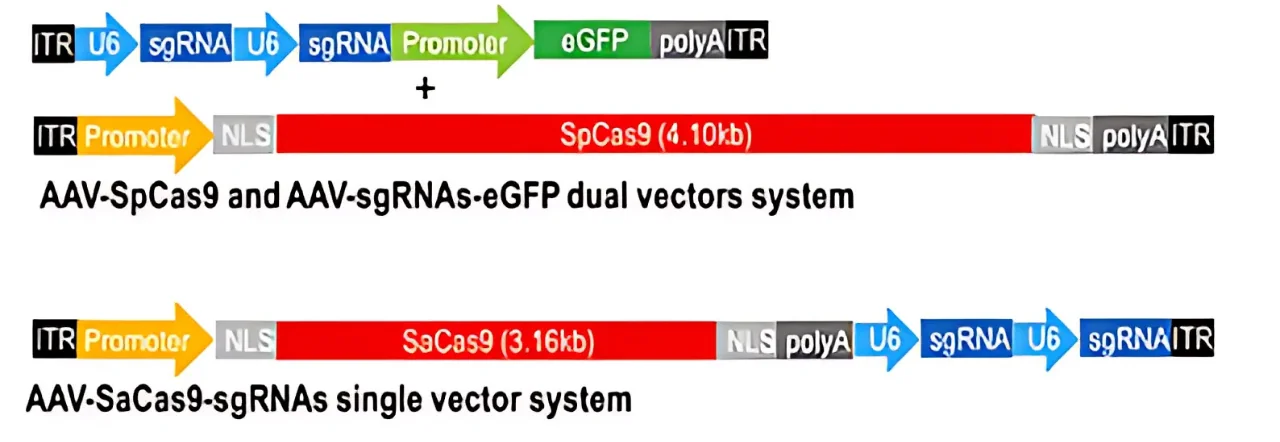
虽然 AAV 是 CRISPR 递送的高效载体,但它们的载货能力相对较小,约为 4.7 千碱基(kb)。 这使得将 Cas9 蛋白和 sgRNA 装入单个 AAV 变得颇具挑战性。例如, SpCas9 (从 化脓性链球菌),这是第一个被广泛使用的Cas9酶,相对较大(约4.2 kb),几乎没有空间容纳必需的调控元件和引导RNA。一种更小、与AAV更兼容的Cas9酶, 萨卡斯9 (从 金黄色葡萄球菌),后来被认为是一种有前途的替代方案,由于其尺寸较小(~3.2 kb),具有更容易包装到 AAV 载体中的优势。
为了克服 AAV 的尺寸限制,已经开发出几种创新策略和方法:
AAV 因其能够高效转导多种细胞类型并保持低免疫原性而成为 CRISPR 递送的广泛选择。然而,优化 AAV 递送需要一些关键工具和策略,以确保基因组编辑的精准性和有效性。这些策略侧重于增强组织特异性表达、gRNA 设计、修复模板递送以及对 Cas9 活性的时间控制。
总之,这些工具和策略为 AAV-CRISPR 传递提供了关键的增强,确保基因编辑过程对于各种治疗应用既有效又安全。
| 分类 | 关键工具/元素 | 标注/优点 |
|---|---|---|
| 推进者成员 | • 普遍存在:CAG、EF1α • 肝脏特异性:TBG、ApoE • 神经元:突触蛋白、CaMKIIα • 肌肉特异性:MHCK7、Desmin | 组织特异性表达;减少脱靶活性 |
| gRNA设计 | • U6、H1启动子(Pol III) • 多重 gRNA | 高效定位;支持复杂的基因组编辑 |
| 修复模板 | • 供体 DNA 共递送 • 双AAV HDR策略 | 精确编辑(例如点突变或插入) |
| 可调控系统 | • 药物诱导型 Cas9(例如 Tet/Dox) • 自失活 Cas9 系统 | 时间控制;降低脱靶和免疫风险 |
体内 基因组编辑涉及将 CRISPR 组件直接递送到生物体中,从而实现系统性或组织特异性的修改,而无需 体外 细胞操作。AAV 尤其 非常适合这种方法 因为它们能够有效地针对特定组织。
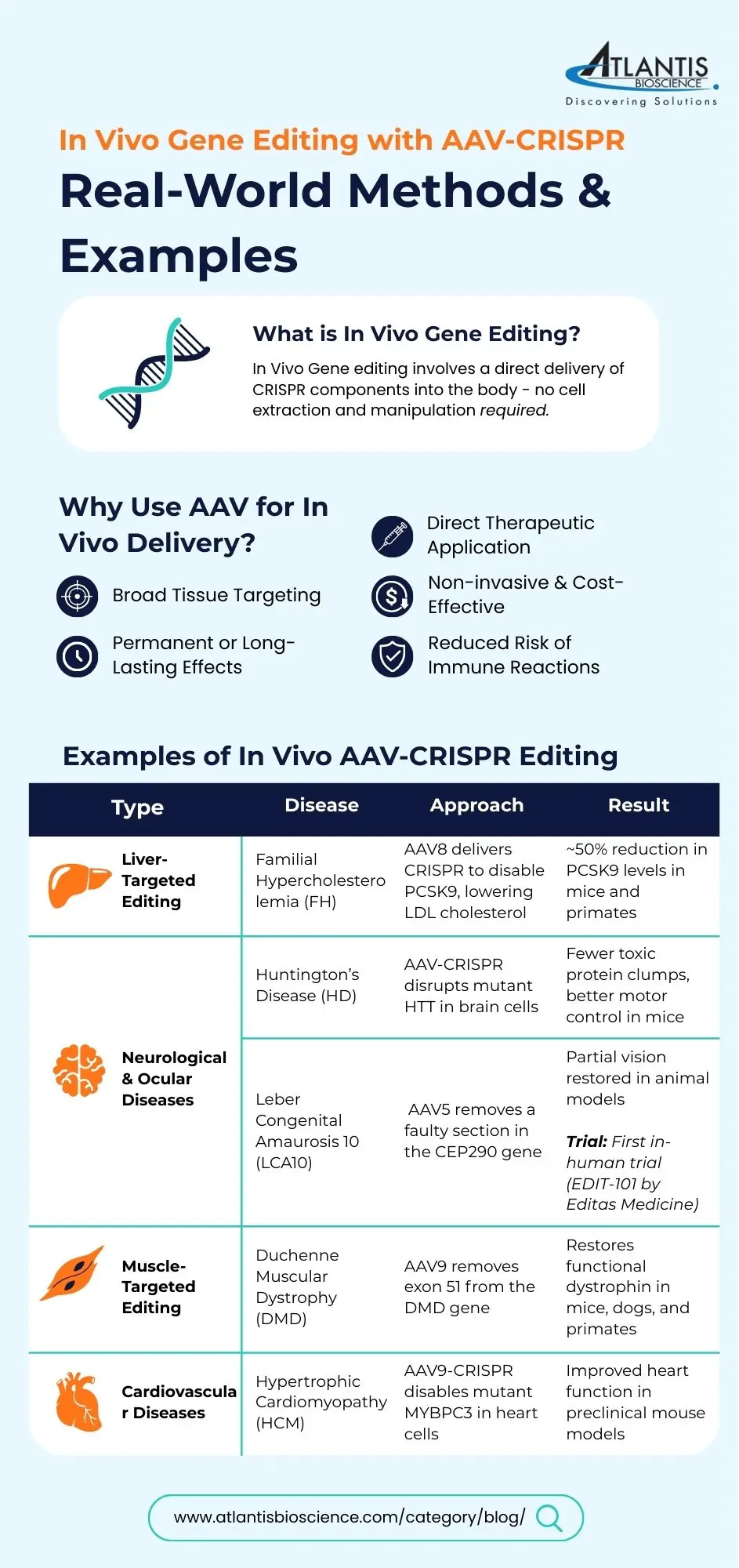
尽管 体内 AAV-CRISPR基因编辑仍面临诸多技术和转化挑战。克服这些障碍对于充分释放基因组编辑在多种疾病治疗中的潜力至关重要。 矢量设计、编辑技术和制造工艺正在塑造该领域的未来方向,旨在提高临床应用的安全性、有效性和可及性。
AAV 介导的 CRISPR 递送是一种有效的策略 体内 基因组编辑技术,提供精准性、组织特异性和长期效应。尽管包装限制和免疫反应等挑战依然存在,但微型编辑器、分离系统和可调控Cas9的创新正在推动该领域的发展。
临床试验(例如针对 LCA101 的 EDIT-10)证明了 AAV-CRISPR 疗法在现实世界中的潜力。随着研究的进展,我们有望在直接治疗患者遗传疾病方面取得更多突破。
PackGene生物技术 已成为 AAV 载体设计、生产和 CRISPR 相关治疗开发领域的领导者。他们提供 定制 AAV 服务 和 即用型(现成)CRISPR/Cas9 rAAV 产品 显著加速 体内 基因编辑研究。
PackGene 的现成 CRISPR/Cas9重组腺相关病毒 产品旨在提供高质量、可靠的结果,并快速交付,确保您的项目顺利推进。无论您需要广泛表达还是组织特异性靶向,我们的预制 AAV 都能满足您的体内基因组编辑需求。
探索我们 产品目录 今天或 联系我们的团队 讨论我们如何帮助您实现下一次突破!

细胞和基因疗法 (CGT) 的快速发展为治疗多种疾病(包括各种癌症和遗传疾病)提供了变革性潜力。然而,

基因疗法在治疗甚至治愈曾经被认为无法治愈的疾病方面有着巨大的前景。某些癌症、β-地中海贫血和视网膜营养不良等疾病受益于此

那么,AAV 到底是什么?腺相关病毒 (AAV) 于 1965 年由 Bob Atchison 和 Wallace Rowe 首次发现,他们观察到它们是复制缺陷型颗粒