- 您的购物车是空的
- 继续购物


一旦掌握了基础知识——准备培养瓶、喂养细胞、汇合后传代——细胞培养看似简单,但真正的卓越之处在于细节。关键参数的微小偏差都可能给实验带来巨大的不一致,导致意外的变异、细胞表型丢失,甚至检测失败。
这不仅仅关乎技术:你使用的材料,比如你的基础培养基(比如 记忆体, 零售价格指数或 的MEM) 和补充剂,例如 胎牛血清(FBS),在影响细胞行为方面发挥着至关重要的作用。培养基成分、血清批次质量或培养条件的变化会显著影响生长率、活力、形态和实验可重复性。即使使用值得信赖的品牌,监测和优化培养环境仍然至关重要。
无论您研究的是原代细胞、间充质干细胞还是永生化细胞系,了解和跟踪特定的培养指标都可以确保细胞健康、提高可重复性并增强实验结果。
在本文中,我们重点介绍 七个关键数字 每个研究人员都应该监测并解释为什么它们对于获得一致、高质量的结果很重要。

这个 传代数 反映出一个细胞群被 传代的 (分裂并重新接种到新的培养皿中)自最初分离或从冷冻保存中复苏以来。每次传代都标志着一轮细胞扩增和增殖。
虽然传代次数通常被视为常规指标,但它在确定 细胞质量、性能和实验可重复性随着时间的推移,细胞在生长过程中积累分子和表观遗传变化 细胞/组织 培养。这些变化可能导致行为发生重大转变,例如基因表达改变、增殖减慢、活力降低或不必要的分化——即使细胞形态保持不变。
监测并记录通道数量可确保:
未能追踪通道数量可能导致 无法重复的结果, 误导性结论及 浪费资源 — 尤其是在长期研究或临床前开发过程中。
在常规细胞培养中,每次传代培养或重新接种都算作一次传代。
然而,一个常见的问题出现了:
解冻冷冻细胞算不算新的传代?
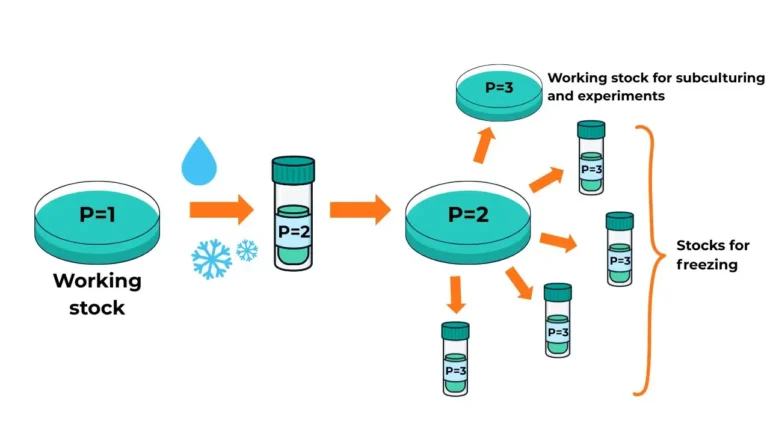
答案是: 没有 — 通道数应随 重新播种,不 冷冻.
计费示例:
如果你有一个工作细胞系 第1段(P1),然后用胰蛋白酶消化并冷冻这些细胞,然后把小瓶标记为 P2解冻后,它们仍然 P2 直到你再次对它们进行亚培养,此时它们就变成了 P3.
传代数 不考虑分流比或接种密度因此对细胞实际分裂次数的了解有限。
考虑这种情况:
然而,1:10 分裂的细胞必须增殖更多才能达到汇合,这意味着它们会经历 人口倍增(PD)更多。 随着时间的推移,即使传代次数相同,也会导致细胞在基因和功能上有所不同。
监测 PD 与传代次数和倍增时间可以 多维文化健康观,从而能够做出更好的决策,特别是在长期或转化研究中。

细胞接种密度 — 每单位面积(对于贴壁细胞)或每单位体积(对于悬浮细胞)接种的细胞数 — 是 基本参数 在细胞培养中。它直接影响生长速度、形态、基因表达以及下游检测的结果。
播种不正确可能导致:
保持适当的播种密度可确保:
| 电池类型 | 推荐播种密度 |
| 贴壁细胞 | 5,000–50,000 个细胞/cm² |
| 悬浮细胞 | 2×104 至5×105 细胞/毫升 |
这些只是一般范围。最佳密度会根据细胞类型、检测类型、培养容器大小和实验目标而有所不同。
专业提示: 建议在解冻后立即接种比常规传代期间更多的细胞,因为解冻后的细胞活力通常较低。
细胞密度要求差异很大,取决于:
查阅已发表的文献并进行初步实验,以确定最适合您特定系统的接种密度。适用于某个实验室或细胞系的方法可能不适用于其他实验室或细胞系。
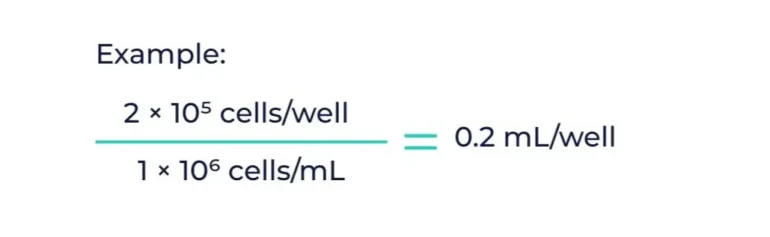
以下是帮助您计算实验正确接种密度的快速指南:

计费示例: 2孔板需要每孔10 × 6⁵细胞。如果每毫升细胞密度为1 × 10⁶,则每孔需要0.2毫升细胞。

细胞汇合 指贴壁细胞覆盖培养表面的百分比。它是细胞增殖和整体培养健康状况的快速且重要的视觉指标。
汇合度不仅仅是一个常规指标,它还用于指导整个细胞培养工作流程的决策——从传代和冻存到实验处理和分化。重要的是, 细胞行为, 基因表达及 对外界刺激的反应 都受到汇合水平的高度影响。
汇合度不是直接计数细胞,而是 表面覆盖度的视觉评估. 例如,70%汇合的培养瓶有70%的表面积被贴壁细胞占据。
如果使用得当,汇合度有助于确定:

未能在正确的时间传球可能导致:
尽管汇合度很重要,但通常仍需在显微镜下目测。这种“猜测”具有主观性,不同用户——甚至同一个人在不同日期——的汇合度也可能存在差异。汇合度估算在 60% 到 90% 之间(这是许多操作中最关键的范围),尤其容易出错。
准确且一致地估计汇合支持:
| 实践应用 | 目标汇合度 | 合理 |
| 增殖试验 | 60-80% | 确保积极增长 |
| 转染/转导 | 70-90% | 平衡生存力和最佳吸收 |
| 区别 | 因细胞类型而异 | 有些需要高密度;有些则需要空间进行形态发生的变化 |
| 冷冻保存 | 70-90% | 让细胞处于最佳健康状态,以便解冻后恢复 |
| 解冻后膨胀 | 50-70% | 防止过度拥挤并支持健康再生 |
过度汇合是一个可预防的问题,但它可能会破坏整个实验。请采取以下主动策略:

细胞活力 是细胞整体健康状况的关键指标,对于确保实验结果可靠且可重复至关重要。无论您是进行转染、药物检测、分化研究,还是制备用于冻存的细胞,维持较高的细胞活力百分比都有助于确保获得一致且生理相关的结果。
生存能力低下会导致:
FBS 是许多培养基配方中最关键的成分之一。它提供 必需生长因子、激素、粘附分子以及支持 细胞附着、增殖和存活.
运用 值得信赖的高品质FBS 对于维持生存至关重要,因为:
专业建议: – 始终从信誉良好的供应商处采购胎牛血清,这些供应商应提供:
高生存力不仅仅意味着生存,还意味着 确保你的细胞健康、活跃并表现正常. 值得信赖的试剂,例如 认证FBS 形成可靠文化体系的骨干。

支原体污染 支原体污染是细胞培养中最隐蔽、最难诊断的问题之一。与细菌或真菌污染不同,支原体不会造成培养基浑浊,而且常常不被察觉,但却悄无声息地破坏着实验的完整性。
这些微小的、无细胞壁的细菌可以:
| 情况 | 测试频率 |
| 常规细胞培养维护 | 每 4-6 周 |
| 在关键实验之前 | 至少提前一周 |
| 冷冻保存细胞库存之前 | 强制性 |
| 解冻储存的细胞后 | 解冻后 3-5 天内 |
| 获得新的细胞系后 | 抵达后立即 |
| 抗生素治疗后或疑似污染后 | 需要进行后续测试 |
主动、定期的支原体检测和频繁 支原体净化实践 只需投入少量的时间,就能节省数月的劳作时间。


这个 培养基pH值 在影响方面发挥着至关重要的作用 细胞活力、新陈代谢、酶活性及 总体实验可重复性任何偏离最佳pH值范围的情况都可能导致细胞行为改变、数据不可靠,甚至培养完全失败。维持稳定的pH值对于敏感细胞类型(例如原代细胞和干细胞)尤为重要。
哺乳动物细胞的最佳pH值范围通常在 7.2 - 7.4pH 值低于 7.2 被视为酸性,而 pH 值高于 7.4 被视为碱性。
酸性条件 – 通常表示 过度生长的文化 或可能 微生物污染当细胞代谢营养物质时,它们会释放酸性副产物,例如乳酸,从而降低pH值。这在密集培养或培养基更换频率不高的情况下尤为常见。
碱性条件 – 可能源于 二氧化碳不足₂ 各级 在孵化器中或 长时间暴露 培养皿与空气接触。当细胞代谢不活跃时,例如细胞死亡后或解冻后早期,也可能出现这种情况。
酚红是细胞培养基中常见的 pH 指示剂,它会从粉色(中性)变为橙色或黄色(酸性),从而 视觉提示 实时监测培养基状态。培养基变黄表示酸度升高,通常表明需要更换培养基,无论预定的补料时间如何。

在大多数情况下,酚红是无害的,并且有助于维持健康的培养物。然而,某些 敏感细胞系或实验装置 可能需要 无酚红培养基这是因为酚红具有较弱的雌激素样活性,可能会影响激素反应细胞或干扰对雌激素化合物敏感的检测。它还可能在流式细胞术或荧光检测等技术中引起背景信号。对于这些情况,建议使用不含酚红的制剂。
碳酸氢钠 (NaHCO₃) 是一种天然、无毒的缓冲液,常用于细胞培养基。它需要 5% 二氧化碳培养箱 起到缓冲作用,因为二氧化碳溶解在培养基中,形成碳酸,碳酸与碳酸氢根离子相互作用, 稳定pH值.
培养基中 NaHCO₃ 的含量决定了维持 pH 值所需的 CO₂ 含量。正常组织的生理 pH 通常认为在 7.2 到 7.4 之间,但某些疾病状态(例如癌症)可能需要在较低的 pH 下培养。添加了 Earle 平衡盐溶液 (EBSS) 的 Eagle 最低必需培养基 (EMEM) 和大多数其他细胞培养基通常含有 26 mM 碳酸氢钠,而 DMEM 的浓度更高,为 44 mM。

HEPES(4-(2-羟乙基)-1-哌嗪乙磺酸)是一种 两性离子有机缓冲液 广泛用于细胞培养,以维持稳定的pH值,尤其是在二氧化碳水平可能波动的环境中。HEPES在 pH 值范围 6.8 至 8.2,使其适用于多种哺乳动物细胞系。
生物西 提供种类丰富的基础培养基配方,以满足研究人员在处理各种细胞类型和实验条件时的不同需求。无论是培养稳定的永生化细胞系、敏感的原代细胞还是干细胞,Biowest 都能提供 即用型培养基 含或不含 HEPES 和碳酸氢钠,以支持最佳 pH 控制和缓冲。
标准选项包括:

内毒素,也称为 脂多糖(LPS), 内毒素是革兰氏阴性细菌外膜的组成部分。这些分子在细菌生长过程中会少量释放,而在细菌裂解时则会大量释放。即使是微量的内毒素也会损害培养细胞的健康,尤其是在干细胞扩增、免疫疗法开发、生物生产或炎症性疾病建模等敏感应用中。它们的影响通常很微妙,但可能导致不稳定、不可重复或误导性的实验结果。
即使浓度较低,内毒素也能:
特别容易受到内毒素影响的细胞类型包括:
内毒素可以通过多种途径进入您的培养系统:
使用无内毒素水或超纯水 – 用于制备缓冲液、清洗玻璃器皿或稀释培养基的水必须是高纯度的(例如,I 型超纯水)并且经过认证不含内毒素。
选择优质、低内毒素的FBS – FBS 是内毒素的常见来源。请选择经供应商认证为低内毒素水平的批次——理想情况下,对于一般应用,内毒素水平应低于 10 EU/mL;对于敏感应用,内毒素水平应低于 1 EU/mL。 比奥韦斯特 FBS 经过 LAL 测试并提供批次特定证书。
确认培养基和添加剂的内毒素检测 – 确保基础培养基、补充剂(例如生长因子、抗生素)和缓冲液在严格的质量控制下生产,并经过内毒素污染测试。
遵循正确的玻璃器皿高压灭菌程序 – 残留内毒素具有热稳定性,因此要确保玻璃器皿不仅要消毒,而且在必要时还要去除热原——通常采用≥250°C 的干热灭菌,持续 30 分钟。
使用经认证的无内毒素塑料器皿 – 选择经制造商认证为无内毒素的一次性塑料器皿(例如,移液器吸头、试管、烧瓶)。避免重复使用或清洗可能接触过环境污染物的实验室器皿。
尽量减少接触环境污染物 – 在无菌环境中快速操作。仅在层流罩下打开培养容器,并减少在培养箱外的操作时间,以最大程度地降低环境内毒素暴露的风险。
比奥韦斯t 提供 FBS 和基础培养基 经过 LAL 测试并提供 批次特定分析证书 内毒素水平,确保 一致性和可靠性 跨实验。其严格的质量控制流程即使在最敏感的应用中也能确保可重复的高性能结果。
Biowest 的 超低内毒素胎牛血清 专为满足敏感细胞培养系统的严格要求而设计。每批产品均经过精心配制和全面测试,符合严格的内毒素阈值,是培养原代细胞、干细胞以及用于临床或生物制药应用的细胞的理想选择。Biowest 可确保您的细胞在支持以下两方面的环境中生长: 生存力和完整性.
细胞培养既是一门技术科学,也是一门数值科学。掌握关键的定量参数——例如 传代次数、接种密度和汇合率——可能意味着可重复结果和实验失败之间的差异。同样重要的是一些不太明显但关键的指标,例如 活力、支原体检测频率、培养基 pH 值和内毒素水平这七个数值共同构成了稳健可靠的细胞培养系统的基础。通过保持警惕并了解这些数值,研究人员可以提高一致性,保护细胞健康,并确保获得有意义的结果——无论是使用标准细胞系还是推进敏感的临床应用。
不要错过这个 独家促销 来自 Atlantis Bioscience 和 Biowest!限时优惠,购买任意 10 瓶 Biowest 优质细胞培养基或试剂,即可获赠第 11 瓶 免费— 自动应用于您订单中价值最低的商品。这是您囤积高品质研究必需品的绝佳机会,同时还能节省更多。
立即领取您的免费瓶子。
Bio,C.(2024 年 19 月 XNUMX 日)。 了解细胞培养基中的 pH 值和渗透压. Captivate Bio。 https://captivatebio.com/understanding-ph-osmolality-cell-culture-media/
细胞培养:技术、类型和生长监测 | 丹纳赫生命科学.(nd). 丹纳赫生命科学。 https://lifesciences.danaher.com/us/en/library/cell-culture.html#:~:text=The%20optimal%20CO2%20level%20for,can%20be%20toxic%20to%20cells.
细胞活力检测 | Abcam。 (nd)。 https://www.abcam.com/en-us/technical-resources/guides/cell-health-guide/cell-viability-assays#:~:text=Briefly%2C%20cell%20viability%20is%20the,get%20washed%20away%20during%20trypsinizing.
细胞培养实验室中的二氧化碳浓度和pH值控制.(nd). 培养物保藏。 https://www.culturecollections.org.uk/culture-collection-news/co2-concentration-and-ph-control-in-the-cell-culture-laboratory/
维持细胞 | ATCC。 (nd)。 https://www.atcc.org/the-science/culturing-cells/maintaining-cells
Office,S.(2025 年 25 月 XNUMX 日)。 IND申请中细胞和基因治疗的CMC要求 | BioAgilytix. 百奥艾力特。 https://www.bioagilytix.com/blog/cmc-requirements-for-cell-and-gene-therapy-for-ind-applications/
活细胞百分比.(nd)。ScienceDirect。 https://www.sciencedirect.com/topics/immunology-and-microbiology/percentage-of-viable-cells


Biowest 与通用血清:为何质量在细胞培养中如此重要?使用值得信赖的试剂确保可重复性和可转化性。了解更多。

通知