- 您的购物车是空的
- 继续购物


我们用来管理健康的药物代表了一段非凡的科学历程的巅峰。在本系列文章中,我们将深入研究令人着迷的药物开发世界,细致剖析药物开发的每个阶段。 复杂的过程。从最初发现有希望的分子到为突破性新疗法铺平道路的严格测试,我们将探索改善无数人生活的药物背后的科学。准备踏上探索之旅,并更深入地了解使这些改变生活的进步成为现实的奉献精神和专业知识。
药物开发的第一阶段通常称为发现和开发,为整个过程奠定基础。在这一阶段,可以发现和培育潜在新药的最初火花。以下是这一关键阶段的细分:
目标识别和验证:
这一旅程始于一种特定的疾病或病症。研究人员深入研究潜在的生物过程,以确定在疾病进展中起关键作用的目标分子——蛋白质、酶或受体。这一目标成为药物开发工作的重点。
寻找潜在候选药物的策略有多种:
潜在客户优化:
一旦确定了有希望的候选分子(“先导”),研究人员就会努力优化其特性。这可能涉及:
药物开发的第二阶段,即临床前研究,是初始发现阶段与人体测试之间的重要桥梁。在此阶段,第一阶段确定的潜在候选药物将在受控实验室环境中接受严格测试,以评估其安全性和潜在有效性,之后才能用于人体。
临床前研究的关键方面:
试管婴儿 学习:
**查看 Atlantis Bioscience 提供的这些解决方案,了解您的 细胞/组织 学习: 3D 解决方案, 微流控, 原代肝细胞, 仿生膜
体内 学习:
**查看 Atlantis Bioscience 提供的这些解决方案,了解您的 细胞/组织 学习 : 鼠标型号, 临床前测试服务
临床前研究的重要性:
道德考虑:
研究人员有道德义务在临床前研究期间尽量减少动物的痛苦。有严格的指导方针来确保药物开发中使用的动物得到人道对待。动物模型的使用有局限性,它们对药物的反应可能并不总是完全适用于人类。然而,它们仍然是药物开发早期阶段必不可少的工具。
临床研究是药物开发的第三阶段,标志着首次对潜在药物进行人体测试。此阶段对于确定药物的安全性、有效性以及治疗特定疾病的最佳剂量至关重要。以下是临床研究的具体内容:
严谨、道德:
临床研究是一个受到严格监管且符合道德规范的过程。FDA(食品药品管理局)等监管机构的严格指导和监督确保了参与者的安全和健康。
新药研究流程:
药物开发商或赞助商必须提交 研究性新药 (IND) 在开始临床研究之前,向 FDA 提交申请,以获得对人体施用试验药物的授权。IND 申请通常包括动物药理学和毒理学研究、制造信息和临床方案的信息。通过提交准备充分的 IND 申请,申办方可以获得 FDA 批准进行临床试验,这是开发安全有效的新药的关键步骤。
分阶段方法:
临床研究通常采用分阶段的方法,每个阶段都以前一阶段的发现为基础:
知情同意:
参与临床研究是自愿的。患者必须经过严格的知情同意程序,其中会详细解释研究的目的、潜在风险和益处以及作为参与者的权利。
临床研究的重要性:
临床研究的挑战:
这个 新药申请(NDA) 是新药合法上市和开给患者处方前需要通过的最后一道关卡。NDA 提交给 FDA,是药物赞助商(制药公司、研究人员)的正式提案,请求批准销售其用于特定医疗状况的药物。FDA 严格审查 NDA,这是一个漫长的过程,需要数月甚至数年,因为 FDA 会一丝不苟地确保药物符合其严格的安全性和有效性标准。
FDA 的作用:
FDA 充当守门人,确保新药在上市前的安全性和有效性。他们的审查过程包括彻底检查药物开发过程中收集的所有数据:
团队努力:
FDA 审查过程涉及一个专家团队,包括医生、药理学家、化学家、统计学家和其他专家。每个团队成员都会仔细评估提交的数据,以确保药物符合以下标准:
可能的结果:
FDA 审查过程可能产生多种结果:
药物的旅程不会随着 FDA 批准而结束。药物开发的第五个也是最后一个阶段是 FDA 上市后安全监测,该阶段确保药物在上市后仍能继续保持警惕。以下是这一持续过程至关重要的原因:
为什么要批准后进行监控?
临床试验虽然全面,但参与者人数有限,可能无法涵盖所有潜在副作用,尤其是罕见副作用。此外,长期影响和与其他药物的相互作用在临床试验期间可能无法完全显现。
FDA 的积极作用:
FDA 拥有一套强大的上市后安全监测计划,用于识别已获批准药品中任何不可预见的安全问题。该计划依赖于以下几个关键要素:
上市后监测的好处:
共同责任:
虽然 FDA 在上市后监督中发挥着核心作用,但医疗保健专业人员和患者也有责任报告已获批准药物的任何不良事件。此报告有助于更全面地了解药物的安全性。
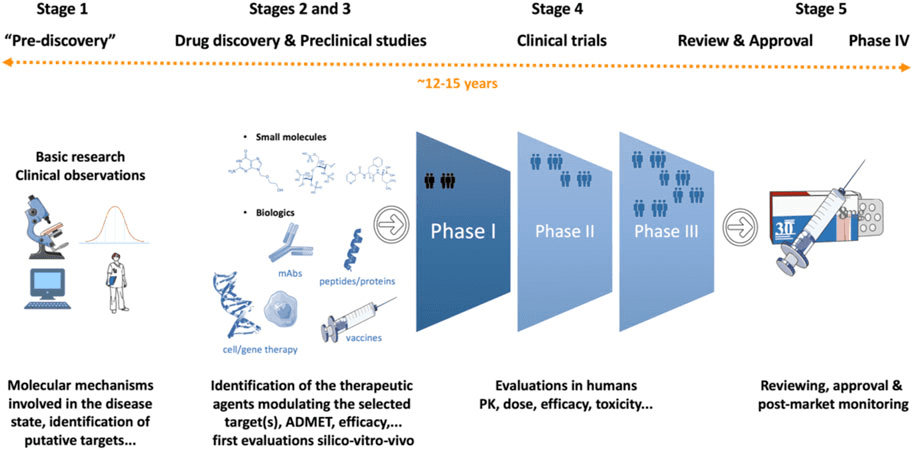
图 1:药物发现和开发过程。
图片来源:Singh N.、Vayer P. 等人, doi: 10.3389/fddsv.2023.1201419。
转载下 知识共享许可
结束语
从科学推测到救命药物的研发过程漫长而复杂。研发新药并将其推向市场通常需要 12-15 年的时间,成本约为 2.8 亿美元。这些惊人的数字凸显了将科学创新转化为患者切实利益所需的巨大奉献、专业知识和资源。
如今,药物开发过程中的竞争环境要求保持微妙的平衡。研究人员力求应用严格的定性和定量分析,以在尽可能短的时间内将主要候选药物推向市场。然而,这种对效率的追求绝不能损害对确保患者健康至关重要的细致测试和安全评估。
随着我们不断前进,技术和研究方法的令人振奋的进步有可能简化药物开发流程,同时保持最高的安全标准。通过促进合作和创新,我们可以加快发现和向有需要的患者提供改变生活的药物。
参考文献:
Chang Y、Hawkins BA、Du JJ、Groundwater PW、Hibbs DE、Lai F。计算机药物设计指南。药剂学。2022 年 23 月 15 日;1(49):10.3390。doi:15010049/pharmaceuticsXNUMX。
Savoji H、Mohammadi MH、Rafatian N 等人。心血管疾病模型:药物发现和筛选领域的变革性范例。生物材料。2019;198:3-26。doi:10.1016/j.biomaterials.2018.09.036
Singh N, Vayer P, Tanwar S, Poyet J, Tsaioun K, Villoutreix BO。药物发现与开发:向公众和患者群体介绍。药物发现前沿。2023;(3)。doi:10.3389/fddsv.2023.1201419

了解细胞治疗初创公司如何利用关键工艺参数 (CPP) 来确保产品质量、有效扩展规模并满足监管标准。


基因疗法在治疗甚至治愈曾经被认为无法治愈的疾病方面有着巨大的前景。某些癌症、β-地中海贫血和视网膜营养不良等疾病受益于此