แล้ว AAV คืออะไรกันแน่? ไวรัสที่เกี่ยวข้องกับอะดีโน (AAVs) ถูกระบุครั้งแรกในปีพ.ศ. 1965 โดย บ็อบ แอตชิสันและวอลเลซ โรว์ ซึ่งสังเกตเห็นว่าเป็นอนุภาคที่บกพร่องในการจำลองแบบภายในตัวอย่างอะดีโนไวรัส ซึ่งอยู่ใน ไวรัสดีเพนโดพาร์โว สกุลภายใน Parvoviridae AAV มีลักษณะเฉพาะตัวตรงที่ต้องอาศัยไวรัสตัวช่วย เช่น อะดีโนไวรัสหรือไวรัสเริม เพื่อทำให้การจำลองสมบูรณ์ ในกรณีที่ไม่มีไวรัสตัวช่วย AAV จะยังคงอยู่ในเซลล์โฮสต์โดยไม่ก่อให้เกิดโรค ทำให้ปลอดภัยเป็นพิเศษสำหรับการนำส่งยีน
ในรูปแบบไวด์ไทป์ AAV สามารถรวมเข้ากับตำแหน่งเฉพาะบนโครโมโซม 19 ของมนุษย์ (AAVS1) ได้ โดยได้รับการควบคุมจากโปรตีน Rep อย่างไรก็ตาม AAV แบบรีคอมบิแนนท์ (rAAV) ได้รับการออกแบบโดยไม่ใช้ Rep จึงรักษาการมีอยู่ที่ไม่ผสานรวมภายในเซลล์ได้อย่างเสถียร ลักษณะเฉพาะของ rAAV ในลักษณะเอพิโซมนี้ช่วยลดความเสี่ยงของการกลายพันธุ์แบบแทรก (การกลายพันธุ์ที่เกิดขึ้นเมื่อลำดับดีเอ็นเอจากภายนอกรวมเข้ากับจีโนมของสิ่งมีชีวิตโฮสต์) และเพิ่มความปลอดภัยในการบำบัดด้วยยีน AAV ยังมีขนาดเล็กมาก โดยมีเส้นผ่านศูนย์กลางประมาณ 25 นาโนเมตรและขนาดจีโนมเพียง 4.7 กิโลเบส (kb) ทำให้เหมาะสำหรับการถ่ายโอนยีนเข้าไปในเซลล์ประเภทต่างๆ
กับพวกเขา โปรไฟล์ความปลอดภัย , ภูมิคุ้มกันต่ำ และ ความยืดหยุ่นในการกำหนดเป้าหมายเนื้อเยื่อเฉพาะ AAV ได้กลายเป็นเครื่องมือชั้นนำในการบำบัดและการวิจัยยีน ซึ่งขับเคลื่อนความก้าวหน้าในการรักษาโรคทางพันธุกรรมและโรคที่เกิดขึ้น
ลักษณะสำคัญของ AAV ในฐานะเวกเตอร์ AAV มีคุณลักษณะเฉพาะและส่วนประกอบเฉพาะหลายประการที่ทำให้เป็นพาหะที่มีคุณค่าสำหรับการวิจัยและการประยุกต์ใช้ในการรักษา
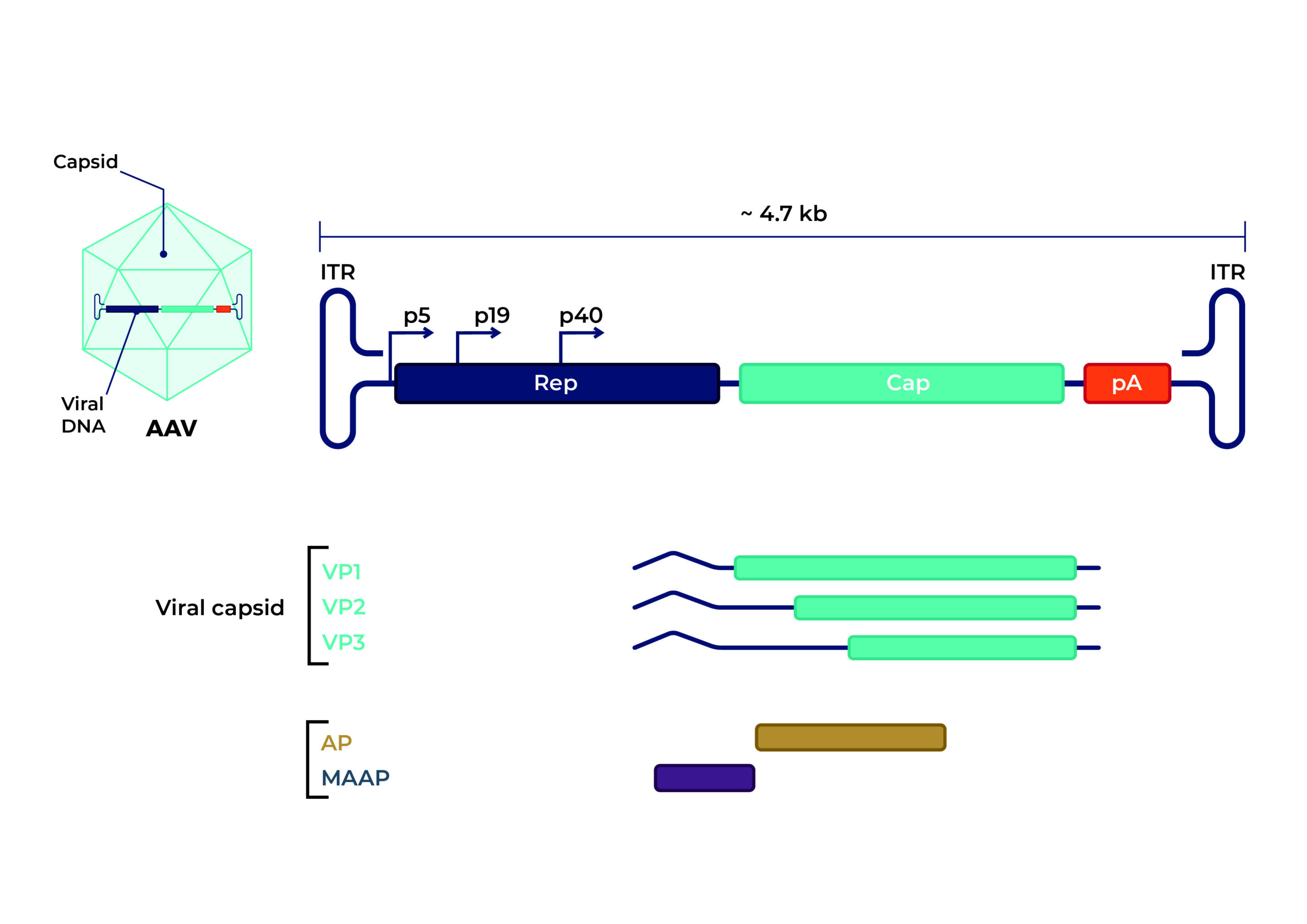
จีโนมและส่วนประกอบของ AAV จีโนม AAV เป็นโมเลกุลดีเอ็นเอสายเดี่ยวขนาดเล็ก (ssDNA) ขนาดประมาณ 4.7 กิโลเบส ประกอบด้วยกรอบการอ่านเปิดที่จำเป็นสองกรอบ (ORF):
ยีนการจำลองแบบ (ตัวแทนจำหน่าย ) ORF เข้ารหัสยีนจำลองแบบที่ไม่ใช่โครงสร้างสี่ยีน
ยีนแคปซิด (ฝาครอบ ) ORF เข้ารหัสยีนแคปซิดโครงสร้างสามยีน
ORF เพิ่มเติมภายใน ฝาครอบ ยีนที่เข้ารหัสสำหรับโปรตีนเสริมที่เกี่ยวข้องกับเยื่อหุ้มเซลล์ (MAAP) และโปรตีนที่กระตุ้นการประกอบ (AAP) ได้รับการระบุแล้ว แม้ว่าฟังก์ชันจะยังไม่ชัดเจน
คุณลักษณะสำคัญของ AAV ได้แก่:
การทำซ้ำเทอร์มินัลแบบกลับด้าน (ITRs): ITR 145 เบสสองตัวที่อยู่ที่ปลายแต่ละด้านของจีโนม AAV มีบทบาทสำคัญในการจำลองแบบของ AAV การทำซ้ำเหล่านี้ช่วยให้จับคู่เบสได้เพื่อสังเคราะห์สายดีเอ็นเอที่เสริมกันยีนตัวแทน: ยีน Rep เข้ารหัสโปรตีนที่จำเป็นต่อวงจรชีวิตของ AAV ได้แก่ Rep78, Rep68, Rep52 และ Rep40 ซึ่งจำเป็นสำหรับการจำลองและการบรรจุยีนแคป: ยีน Cap เข้ารหัสโปรตีนแคปซิดสามชนิด (VP1, VP2 และ VP3) ซึ่งสร้างแคปซิดของไวรัสในอัตราส่วน 1:1:10 ทำให้ AAV สามารถกำหนดเป้าหมายไปที่เนื้อเยื่อเฉพาะได้
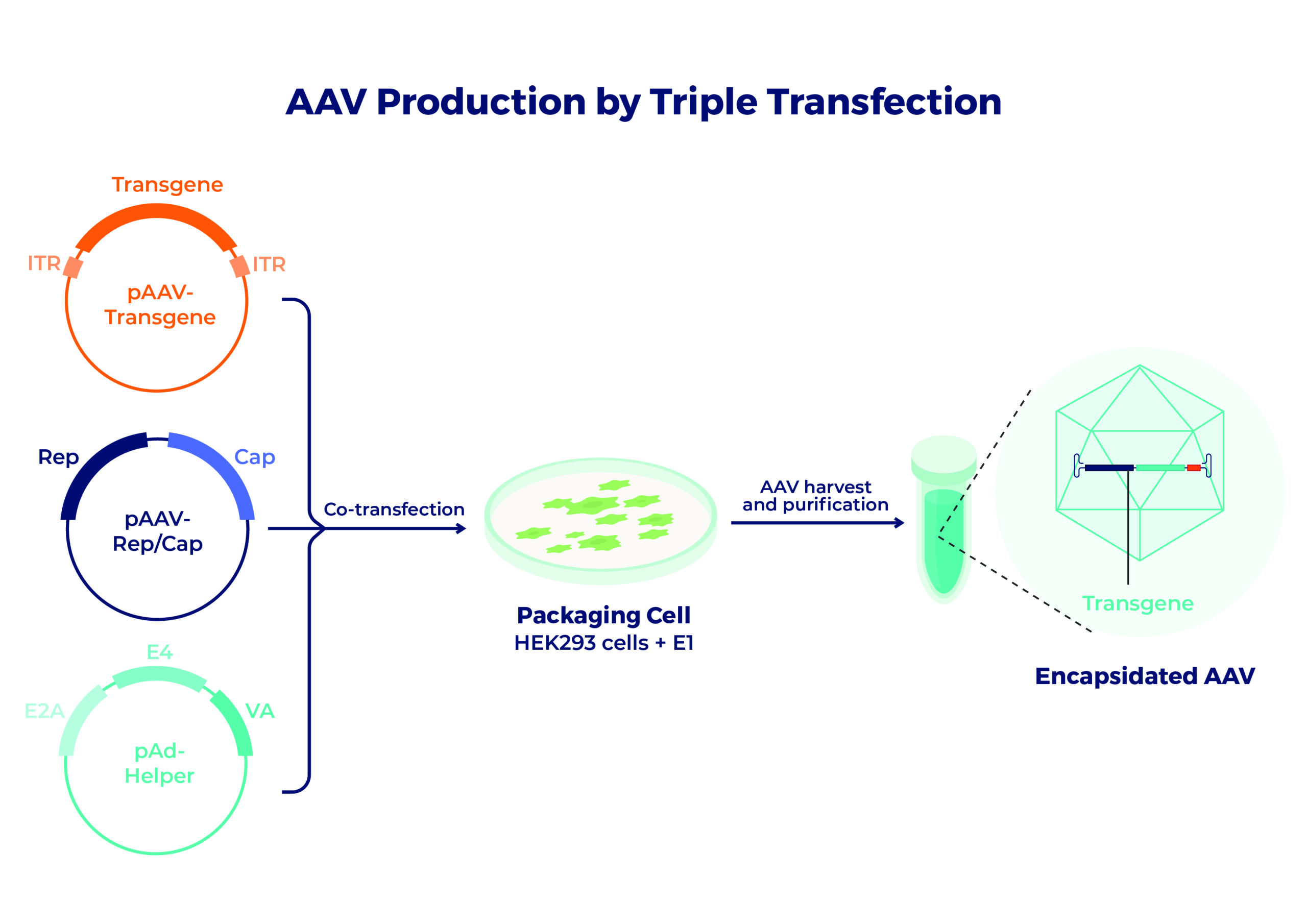
สำหรับการใช้งานยีนบำบัด ทรานส์ยีนที่น่าสนใจจะถูกแทรกระหว่าง ITR ทั้งสองภายในพลาสมิดถ่ายโอน AAV ยีน Rep และ Cap จะถูกป้อนแยกกันในลักษณะทรานส์ระหว่างกระบวนการผลิต
เอเอวี ความต้องการไวรัสตัวช่วย
เนื่องจากเป็นไวรัสที่ไม่สามารถจำลองแบบได้ AAV จึงต้องใช้ไวรัสตัวช่วยหรือพลาสมิดตัวช่วยเพื่อกระตุ้น พลาสมิดตัวช่วยจะให้ยีนอะดีโนไวรัสที่จำเป็น ได้แก่ E4, E2a และ VA ซึ่งทำหน้าที่ควบคุมการจำลองแบบของ AAV ในห้องปฏิบัติการ พลาสมิดถ่ายโอน AAV (ที่มีทรานส์ยีน) พลาสมิด Rep/Cap และพลาสมิดตัวช่วยจะถูกถ่ายโอนร่วมกันเข้าไปในเซลล์ HEK293 ซึ่งยังจัดหายีนอะดีโนไวรัส E1 เพื่อผลิตอนุภาค AAV ที่ติดเชื้อได้อีกด้วย
ซีโรไทป์ของ AAV และโทรปิซึมของเนื้อเยื่อสำหรับการบำบัดด้วยยีน AAV แสดงให้เห็นถึงความหลากหลายอย่างมีนัยสำคัญในซีโรไทป์ โดยแต่ละซีโรไทป์มีการดึงดูดเนื้อเยื่อเฉพาะตัว ซึ่งหมายความว่า AAV นั้นมีความชอบตามธรรมชาติต่อเซลล์และเนื้อเยื่อเฉพาะ ความหลากหลายนี้ทำให้เหล่านักวิทยาศาสตร์สามารถเลือกซีโรไทป์ AAV ที่เหมาะสมเพื่อกำหนดเป้าหมายไปที่เนื้อเยื่อหรืออวัยวะเฉพาะ ซึ่งถือเป็นสิ่งสำคัญทั้งในการบำบัดด้วยยีนและการประยุกต์ใช้ในการวิจัย
การเปลี่ยนแปลงของแคปซิดตามธรรมชาติระหว่างซีโรไทป์ของ AAV มีอิทธิพลต่อความสามารถในการจับกับตัวรับในเซลล์บางชนิดของซีโรไทป์แต่ละชนิด ซึ่งส่งผลต่อเนื้อเยื่อที่ถ่ายโอนยีนได้อย่างมีประสิทธิภาพสูงสุด โดยการเลือกซีโรไทป์ที่เหมาะสม นักวิจัยสามารถปรับปรุงการส่งยีนไปยังเนื้อเยื่อเป้าหมายได้ในขณะที่ลดผลกระทบนอกเป้าหมายให้เหลือน้อยที่สุด
AAV นำเสนอข้อดีมากมายสำหรับยีนบำบัด รวมถึง:
โปรไฟล์ความปลอดภัย :AAVs ไม่ก่อให้เกิดโรคและก่อให้เกิดภูมิคุ้มกันต่ำ จึงลดความเสี่ยงต่อการตอบสนองภูมิคุ้มกันที่ไม่พึงประสงค์การแสดงออกของยีนในระยะยาว :ช่วยให้การแสดงออกของยีนบำบัดเป็นไปได้ยาวนานขึ้น ซึ่งเป็นประโยชน์ต่ออาการเรื้อรังการทรอปิซึมของเนื้อเยื่อ :ซีโรไทป์ที่หลากหลายช่วยให้สามารถส่งยาไปยังเนื้อเยื่อเฉพาะได้อย่างเลือกสรร ช่วยเพิ่มประสิทธิภาพการรักษาการกลายพันธุ์แบบแทรกน้อยที่สุด :โดยทั่วไปแล้ว AAV จะยังคงเป็นแบบเอพิโซม ซึ่งจะช่วยลดความเสี่ยงของการเปลี่ยนแปลงเป็นมะเร็งให้เหลือน้อยที่สุด
ด้านล่างนี้เป็นภาพรวมของซีโรไทป์ AAV ที่ใช้กันทั่วไปที่สุดบางส่วนและเป้าหมายเนื้อเยื่อที่ต้องการ:
ซีโรไทป์ AAV เนื้อเยื่อเป้าหมาย รายละเอียด AAV1 กล้ามเนื้อลาย หัวใจ ประสิทธิภาพการถ่ายโอนข้อมูลสูงในเนื้อเยื่อกล้ามเนื้อ AAV2 กว้าง (ตับ กล้ามเนื้อ ระบบประสาทส่วนกลาง ตา) ซีโรไทป์ที่ได้รับการศึกษามากที่สุด ดีสำหรับการวิจัยยีนบำบัด AAV5 ปอด, ระบบประสาทส่วนกลาง เน้นการกำหนดเป้าหมายไปที่ปอดและเซลล์ประสาท AAV6 ปอด กล้ามเนื้อ มีประสิทธิภาพในการถ่ายโอนยีนปอดและกล้ามเนื้อ AAV8 ตับ กล้ามเนื้อ การขับสารพิษออกจากตับสูง มักใช้ในการบำบัดที่มุ่งเป้าไปที่ตับ AAV9 หัวใจ, ระบบประสาทส่วนกลาง, ตับ สามารถผ่านทะลุด่านกั้นเลือดสมองได้ มีประโยชน์ในการใช้งานกับระบบประสาทส่วนกลาง เอเอวี-ดีเจ กว้าง ออกแบบมาเพื่อประสิทธิภาพการถ่ายโอนข้อมูลสูงในเนื้อเยื่อหลายประเภท
การเลือกซีโรไทป์มีความสำคัญอย่างยิ่งเมื่อออกแบบการบำบัดหรือการศึกษาวิจัยตาม AAV เนื่องจากจะส่งผลโดยตรงต่อประสิทธิผลและความปลอดภัยของการส่งยีน ตัวอย่างเช่น:
AAV8 และ AAV9 มักถูกเลือกสำหรับการประยุกต์ใช้กับตับและกล้ามเนื้อเนื่องจากประสิทธิภาพการถ่ายโอนข้อมูลในเนื้อเยื่อเหล่านี้สูงAAV9 ความสามารถในการผ่านทะลุด่านกั้นเลือด-สมองได้ขยายขอบเขตการนำไปใช้ในยีนบำบัดสำหรับความผิดปกติทางระบบประสาท เช่น โรคกล้ามเนื้ออ่อนแรง (SMA) และโรคกล้ามเนื้อเสื่อมบางชนิดAAV2 มักใช้ในยีนบำบัดของตา โดยเฉพาะในโรคจอประสาทตา เนื่องจากมีความสามารถในการแทรกซึมชั้นจอประสาทตาได้ดีเยี่ยม
นักวิทยาศาสตร์สามารถออกแบบเวกเตอร์ที่ปรับให้เหมาะกับเนื้อเยื่อเป้าหมายได้โดยใช้คุณสมบัติเฉพาะของซีโรไทป์ AAV แต่ละตัว ซึ่งช่วยให้สามารถส่งมอบยีนได้อย่างแม่นยำและลดผลข้างเคียงที่อาจเกิดขึ้นในเนื้อเยื่อที่ไม่ใช่เป้าหมาย นอกจากนี้ การออกแบบแคปซิดและการสร้างแบบจำลอง (การสลับแคปซิดของซีโรไทป์หนึ่งกับอีกซีโรไทป์หนึ่ง) จะช่วยปรับปรุงความสามารถในการกำหนดเป้าหมายเหล่านี้ให้ดียิ่งขึ้น ซึ่งจะเปิดโอกาสให้มีการประยุกต์ใช้ในการบำบัดและการวิจัยที่หลากหลายยิ่งขึ้น
กลไกการออกฤทธิ์ของ AAV กลไกการทำงานของ AAV เกี่ยวข้องกับขั้นตอนสำคัญหลายขั้นตอน ตั้งแต่การเข้าสู่เซลล์โฮสต์จนถึงการแสดงออกของยีนที่ใช้ในการรักษา การทำความเข้าใจกระบวนการนี้ถือเป็นสิ่งสำคัญสำหรับการปรับให้ AAV เหมาะสมที่สุดสำหรับการใช้งานยีนบำบัด นี่คือภาพรวมโดยละเอียดเกี่ยวกับการทำงานของ AAV:
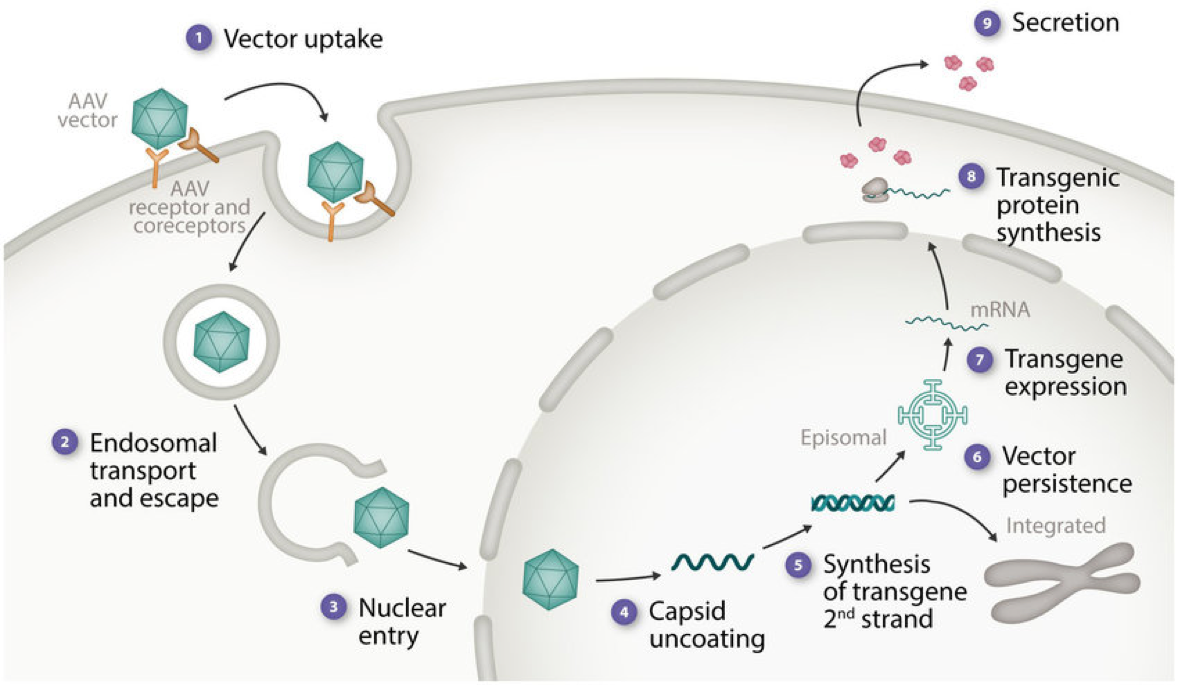
การเข้าสู่เซลล์โฮสต์: AAV เข้าสู่เซลล์โฮสต์โดยหลักผ่านการรับข้อมูลผ่านตัวรับ ซึ่งทำให้ AAV สามารถจับกับตัวรับเฉพาะบนพื้นผิวเซลล์ได้ ปฏิกิริยานี้มักเกี่ยวข้องกับการที่โปรตีนแคปซิดของไวรัสบน AAV จับกับตัวรับ เช่น โปรตีโอกลีแคนของเฮปารินซัลเฟต ตัวรับ AAV (AAVR) และปัจจัยอื่นๆ ของเซลล์ การจับกันนี้จะกระตุ้นให้ไวรัสเข้าสู่เซลล์ภายใน ส่งผลให้ไวรัสเข้าสู่ไซโทพลาซึมการหลบหนีจากเอนโดโซม: เมื่อเข้าไปในเซลล์แล้ว AAV จะถูกห่อหุ้มด้วยเอนโดโซม เพื่อเริ่มต้นระยะต่อไป AAV จะต้องหลบหนีออกจากช่องเอนโดโซม การหลบหนีนี้อาจเกิดขึ้นได้จากการเปลี่ยนแปลงค่า pH ในแคปซิดที่นำไปสู่การเปิดเผยของเปปไทด์ฟิวชันของเยื่อหุ้มเอนโดโซม ซึ่งทำให้ AAV สามารถปล่อยจีโนมของตนลงในไซโทพลาซึมได้การขนส่งไปยังนิวเคลียส: หลังจากหลุดออกจากเอนโดโซมแล้ว AAV จะส่งจีโนม ssDNA ของมันไปที่นิวเคลียส ขั้นตอนนี้ได้รับการอำนวยความสะดวกโดยคอมเพล็กซ์รูพรุนของนิวเคลียส ซึ่งช่วยให้อนุภาคขนาดเล็กสามารถผ่านเข้าไปได้การแปลงจีโนมและการแสดงออกของยีน: ในนิวเคลียส จีโนม AAV จะแปลงจากรูปแบบสายเดี่ยวเป็นรูปแบบดีเอ็นเอสายคู่ โดยอาศัยกลไกการซ่อมแซมดีเอ็นเอของเซลล์โฮสต์ จากนั้นดีเอ็นเอสายคู่จะคงอยู่ในนิวเคลียสเป็นเอพิโซม หรือในกรณีของ AAV แบบป่า จะรวมเข้ากับจีโนมของโฮสต์ที่ไซต์ AAVS1 บนโครโมโซม 19 ผ่านการทำงานของโปรตีน Rep สำหรับ AAV แบบรีคอมบิแนนท์ ซึ่งโดยทั่วไปไม่มี Rep ดีเอ็นเอสายคู่จะยังคงอยู่ในรูปแบบเอพิโซม ซึ่งทำให้สามารถแสดงออกของทรานส์ยีนได้อย่างเสถียรโดยไม่ต้องผสานรวม ลักษณะเอพิโซมนี้ให้ระดับการปกป้องจากการเฝ้าระวังภูมิคุ้มกัน ช่วยให้มีผลการรักษาที่ยั่งยืน การแสดงออกของยีน: เมื่อจีโนม AAV ถูกแปลงและทำให้เสถียรแล้ว ทรานส์ยีนที่แทรกระหว่าง ITR จะสามารถถอดรหัสและแปลเป็นโปรตีนที่เกี่ยวข้องได้ การผลิตโปรตีนนี้ขึ้นอยู่กับองค์ประกอบควบคุมที่รวมอยู่ในพลาสมิดถ่ายโอน ตัวอย่างเช่น การใช้โปรโมเตอร์ที่แข็งแรงสามารถนำไปสู่การแสดงออกของทรานส์ยีนในระดับสูง ในขณะที่โปรโมเตอร์เฉพาะเนื้อเยื่อสามารถรับประกันการแสดงออกที่กำหนดเป้าหมายในเซลล์ประเภทเฉพาะได้
กลไกการออกฤทธิ์ของ AAV ดอย: 10.1097/HS9.0000000000000540สัญญาอนุญาตครีเอทีฟคอมมอนส์ เฮมาสเฟียร์
เวกเตอร์ AAV สำหรับยีนบำบัด ยีนบำบัดจะปรับเปลี่ยนการแสดงออกของยีนหรือเปลี่ยนแปลงการทำงานของเซลล์และเนื้อเยื่อเพื่อรักษาโรค โดยครอบคลุมถึงเทคนิคต่างๆ เช่น การแทนที่ยีน การทำให้ไม่ทำงาน หรือการนำยีนใหม่เข้ามา AAV ได้กลายเป็นเวกเตอร์ที่มีประสิทธิภาพมากที่สุดตัวหนึ่งในการบำบัดด้วยยีน โดยนำเสนอวิธีแก้ปัญหาที่มีแนวโน้มดีสำหรับโรคทางพันธุกรรมและโรคที่เกิดขึ้นได้หลากหลายชนิด คุณสมบัติเฉพาะของ AAV เช่น ความก่อโรคต่ำ ความเสถียร และการตอบสนองต่อเนื้อเยื่อเป้าหมาย ทำให้ AAV เหมาะอย่างยิ่งสำหรับการส่งยีนบำบัดไปยังเซลล์เฉพาะ ศักยภาพนี้ทำให้เกิดความก้าวหน้าที่สำคัญในการรักษาภาวะที่รักษาได้ยากในอดีต โดยการบำบัดด้วย AAV ถือเป็นการบำบัดด้วยยีนตัวแรกๆ ที่ได้รับการอนุมัติจาก FDA
ต่อไปนี้เป็นภาพรวมของยีนบำบัดที่สำคัญตาม AAV ที่ได้รับการอนุมัติจาก FDA และประเภทของโรคที่เหมาะสำหรับการบำบัดด้วย AAV
ยีนบำบัดที่ใช้ AAV ได้รับการอนุมัติจาก FDA ยีนบำบัดที่ใช้ AAV ได้แสดงให้เห็นถึงความสำเร็จอย่างโดดเด่นในทางคลินิก ซึ่งนำไปสู่การอนุมัติจาก FDA หลายรายการสำหรับการบำบัดที่มุ่งเป้าไปที่โรคที่หายากและคุกคามชีวิต:
Leber แต่กำเนิด Amaurosis (LCA): ลักส์ตูร์น่า (voretigene neparvovec-rzyl) ซึ่งเป็นหนึ่งในยีนบำบัดตาม AAV ตัวแรกที่ได้รับการอนุมัติจาก FDA รักษาอาการ LCA โดยส่งสำเนาที่ใช้งานได้ของยีน RPE65 LCA เป็นโรคทางพันธุกรรมที่หายากซึ่งทำให้เกิดความบกพร่องทางการมองเห็นอย่างรุนแรงหรือตาบอดตั้งแต่แรกเกิด การทดลองทางคลินิกแสดงให้เห็นถึงการปรับปรุงการมองเห็นของผู้ป่วยอย่างมีนัยสำคัญ ซึ่งเน้นย้ำถึงศักยภาพในการเปลี่ยนแปลงของ AAV ในการรักษาตาบอดทางพันธุกรรมโรคกล้ามเนื้ออ่อนแรงกระดูกสันหลัง (SMA): โซลเกนสมา (onasemnogene abeparvovec-xioi) ใช้ AAV9 เพื่อส่งมอบสำเนาการทำงานของยีน SMN1 ให้กับผู้ป่วย SMA ซึ่งเป็นภาวะทางพันธุกรรมร้ายแรงที่ส่งผลต่อเซลล์ประสาทสั่งการซึ่งอาจทำให้กล้ามเนื้ออ่อนแรงและเสียชีวิตก่อนวัยอันควร Zolgensma ได้แสดงให้เห็นถึงการปรับปรุงที่สำคัญในด้านการทำงานของระบบการเคลื่อนไหวและการอยู่รอดที่ยาวนานขึ้นในทารกที่ได้รับการวินิจฉัยว่าเป็น SMAฮีโมฟีเลีย: ยีนบำบัดโรคฮีโมฟีเลียใช้ประโยชน์จากเวกเตอร์ AAV ในการกระตุ้นการผลิตปัจจัยการแข็งตัวของเลือด โดยการบำบัดหลายอย่างที่ใช้ AAV ก็ได้ผลลัพธ์ที่มีแนวโน้มดี เฮมเจนิกส์ และ เบคเวซ ใช้เวกเตอร์ AAV เพื่อส่งมอบแฟกเตอร์ IX ให้กับผู้ป่วยโรคฮีโมฟีเลีย B ในขณะที่ ร็อคเทเวียน ซึ่งเป็นการบำบัดด้วย AAV5 แสดงให้เห็นการแสดงออกของแฟกเตอร์ VIII อย่างต่อเนื่องสำหรับผู้ป่วยโรคฮีโมฟีเลียเอ การบำบัดเหล่านี้ถือเป็นความก้าวหน้าครั้งสำคัญในการจัดการโรคฮีโมฟีเลีย โดยลดความจำเป็นในการฉีดแฟกเตอร์การแข็งตัวของเลือดบ่อยครั้งโรคกล้ามเนื้อเสื่อมแบบดูเชนน์ (DMD): เอเลวิดิส (delandistrogene moxeparvovec-rokl) รักษาอาการ DMD ซึ่งเป็นโรคทางพันธุกรรมร้ายแรงที่ทำให้กล้ามเนื้ออ่อนแรงและเสื่อมลงอย่างต่อเนื่อง โดยการนำยีน dystrophin เวอร์ชันดัดแปลง (micro-dystrophin) มาใช้งาน Elevidys จะช่วยฟื้นฟูการทำงานของกล้ามเนื้อบางส่วน ชดเชยการทำงานของ dystrophin ที่ขาดหายไป และมอบความหวังใหม่ให้กับผู้ป่วย DMD
ประเภทของโรคที่เหมาะแก่การบำบัดด้วย AAV การบำบัดด้วย AAV กำลังได้รับการพัฒนาสำหรับโรคต่างๆ โดยเฉพาะโรคทางระบบประสาท จักษุวิทยา เมตาบอลิก ระบบประสาทและกล้ามเนื้อ และหลอดเลือดหัวใจ หมวดหมู่เหล่านี้แต่ละหมวดหมู่ให้โอกาสเฉพาะตัวสำหรับการบำบัดด้วยยีนแบบกำหนดเป้าหมาย
โรคระบบประสาท: กำลังมีการศึกษาวิจัย AAV สำหรับโรคต่างๆ เช่น โรคพาร์กินสันและโรคฮันติงตัน ซึ่งเกี่ยวข้องกับภาวะเสื่อมของระบบประสาท ความสามารถของ AAV ในการส่งยีนที่ใช้ในการรักษาโดยตรงไปยังระบบประสาทส่วนกลางช่วยให้สามารถแสดงออกได้อย่างต่อเนื่อง ซึ่งอาจช่วยเปลี่ยนแปลงความก้าวหน้าของโรคและปรับปรุงผลลัพธ์ของผู้ป่วยได้โรคทางจักษุวิทยา: การบำบัดด้วย AAV แสดงให้เห็นถึงความเป็นไปได้ในการรักษาโรคจอประสาทตาที่ถ่ายทอดทางพันธุกรรม เช่น โรค Leber's congenital amaurosis และโรคเรตินิติสพิกเมนโตซา โรคเหล่านี้มักเกิดจากการกลายพันธุ์ทางพันธุกรรม ทำให้เป็นตัวเลือกที่เหมาะสมสำหรับการบำบัดด้วยการทดแทนยีนเพื่อฟื้นฟูการมองเห็นโรคเกี่ยวกับการเผาผลาญอาหาร: AAV กำลังถูกศึกษาวิจัยถึงศักยภาพในการรักษาโรคทางเมตาบอลิซึม เช่น โรคฟีนิลคีโตนูเรีย (PKU) และโรควิลสัน โดยการส่งมอบยีนที่แก้ไขเส้นทางเมตาบอลิซึม การบำบัดเหล่านี้อาจช่วยจัดการหรือแม้แต่ย้อนกลับผลกระทบของโรคทางพันธุกรรมเหล่านี้ได้โรคระบบประสาทและกล้ามเนื้อ: โรคต่างๆ เช่น SMA และ DMD เป็นเป้าหมายหลักของการบำบัดด้วยยีน AAV โรคเหล่านี้มักเกิดจากการกลายพันธุ์ของยีนที่สำคัญต่อการทำงานของกล้ามเนื้อ และ AAV สามารถอำนวยความสะดวกในการส่งมอบยีนบำบัดที่ส่งเสริมสุขภาพและการทำงานของกล้ามเนื้อโรคหัวใจและหลอดเลือด: นอกจากนี้ ยังมีการศึกษา AAV ในบริบทของโรคหัวใจ ซึ่งสามารถใช้เพื่อส่งมอบยีนที่ช่วยเพิ่มการทำงานของหัวใจหรือป้องกันกระบวนการที่เป็นอันตราย แนวทางนี้มีศักยภาพในการแก้ไขปัญหาทางหลอดเลือดและหัวใจได้หลากหลาย ตั้งแต่โรคหัวใจขาดเลือดไปจนถึงภาวะหัวใจล้มเหลว
การเปลี่ยนแปลงไปสู่โรคที่พบบ่อยมากขึ้น:
แม้ว่าการบำบัดด้วย AAV ในช่วงแรกจะเน้นที่โรคที่หายาก แต่ก็มีความสนใจเพิ่มขึ้นในการขยายแนวทางดังกล่าวไปยังโรคที่พบได้ทั่วไปมากขึ้น เมื่อการวิจัยดำเนินไป เป้าหมายคือการใช้ประโยชน์จากเทคโนโลยี AAV สำหรับโรคต่างๆ ที่หลากหลายมากขึ้น โดยตอบสนองความต้องการทางการแพทย์ที่ไม่ได้รับการตอบสนองอย่างมีนัยสำคัญในกลุ่มผู้ป่วยจำนวนมากขึ้น การเปลี่ยนแปลงนี้ขับเคลื่อนโดยความก้าวหน้าในการบำบัดด้วยยีนและความเข้าใจที่เพิ่มขึ้นเกี่ยวกับศักยภาพของ AAV ในการให้การรักษาที่ยั่งยืนสำหรับโรคที่หายากและโรคที่พบได้บ่อย
ความท้าทายและข้อจำกัดของ AAV AAV มีศักยภาพที่สำคัญสำหรับยีนบำบัดแต่ก็มีข้อจำกัดที่นักวิจัยและแพทย์ต้องแก้ไข:
ภูมิคุ้มกันที่มีอยู่ก่อน: ผู้คนจำนวนมากมีแอนติบอดีที่ต่อต้าน AAV ซีโรไทป์ทั่วไปอยู่แล้ว ซึ่งเป็นผลมาจากการสัมผัสกับ AAV ชนิดป่ามาก่อน ซึ่งอาจลดประสิทธิภาพของการส่งยีนผ่าน AAV โดยเฉพาะอย่างยิ่งในทางคลินิก เพื่อแก้ปัญหานี้ นักวิจัยใช้การคัดกรองผู้ป่วยและกลยุทธ์การคัดเลือกซีโรไทป์เพื่อลดการรบกวนของภูมิคุ้มกันให้น้อยที่สุดความสามารถในการทรานส์ยีนจำกัด: เวกเตอร์ AAV มีความจุในการบรรจุสูงสุดประมาณ 4.7 กิโลเบส ซึ่งจำกัดขนาดของยีนบำบัดหรือปริมาณที่สามารถบรรจุได้ ยีนบำบัดที่มีขนาดใหญ่กว่าหรือโครงสร้างยีนที่ซับซ้อนอาจต้องใช้ระบบ AAV แบบคู่หรือแนวทางทางเลือกเพื่อเพิ่มประสิทธิภาพในการส่งมอบความแปรปรวนในประสิทธิภาพการถ่ายทอดสัญญาณ: ประสิทธิภาพการถ่ายโอน AAV ไม่สม่ำเสมอในเนื้อเยื่อและเซลล์ทุกประเภท โดยได้รับอิทธิพลจากการคัดเลือกซีโรไทป์ เส้นทางการบริหาร และการมีอยู่ของตัวรับเซลล์เฉพาะ นักวิจัยต้องปรับตัวแปรเหล่านี้ให้เหมาะสมอย่างระมัดระวังสำหรับการใช้งานแต่ละครั้งเพื่อให้ส่งมอบยีนได้อย่างมีประสิทธิภาพและตรงเป้าหมายความเสถียรของเอพิโซม: ในขณะที่ DNA ของ AAV ยังคงเป็นแบบเอพิโซมเป็นส่วนใหญ่ ซึ่งช่วยลดความเสี่ยงของการกลายพันธุ์แบบแทรก แต่รูปแบบเอพิโซมนี้อาจมีเสถียรภาพน้อยกว่าในการแบ่งตัวของเซลล์ ซึ่งอาจส่งผลต่อการแสดงออกของยีนเพื่อการบำบัดในระยะยาวได้ศักยภาพในการก่อพิษทางพันธุกรรม แม้ว่าโดยทั่วไป AAV จะมีลักษณะความปลอดภัยที่ดี แต่ยังคงมีความเสี่ยงต่อการกลายพันธุ์แบบแทรกหาก DNA ของ AAV รวมเข้ากับจีโนมของโฮสต์ การผสานนี้สามารถนำไปสู่การเปลี่ยนแปลงเป็นมะเร็ง ซึ่งจำเป็นต้องมีการประเมินความปลอดภัยอย่างละเอียด โดยเฉพาะอย่างยิ่งสำหรับการบำบัดในระยะยาวการผลิตและการควบคุมคุณภาพ: อุปสรรคสำคัญประการหนึ่งในการพัฒนายีนบำบัด AAV อยู่ที่การผลิตและการควบคุมคุณภาพ วิธีการผลิตในปัจจุบันมักต้องใช้สิ่งอำนวยความสะดวกเฉพาะทางขนาดใหญ่ ต้นทุนแรงงานสูง และระยะเวลาการพัฒนาที่กว้างขวางเพื่อให้เป็นไปตามมาตรฐาน GMP ในระดับคลินิก วิธีดั้งเดิมที่พัฒนาในห้องปฏิบัติการทางวิชาการนั้นปรับขนาดได้ยาก และความแปรปรวนจากชุดต่อชุดทำให้การผลิตมีความซับซ้อนมากขึ้น ซึ่งอาจส่งผลต่อทั้งความปลอดภัยและประสิทธิผล การรับประกันอัตราส่วนแคปซิดที่ทำงานได้เต็มที่ในระดับสูงก็เป็นเรื่องท้าทายเช่นกัน เนื่องจากอัตราส่วนที่ไม่สม่ำเสมออาจทำให้ปริมาณยาที่ใช้ในการรักษาเจือจางลง นอกจากนี้ แคปซิดบางครั้งยังบรรจุลำดับดีเอ็นเอที่ไม่ได้ตั้งใจหรือไม่ได้ใช้ในการรักษา ทำให้เกิดข้อกังวลด้านความปลอดภัย ข้อจำกัดด้านกำลังการผลิต การขาดแคลนผู้เชี่ยวชาญที่มีการฝึกอบรม และมาตรฐานการกำกับดูแลที่เข้มงวดยิ่งทำให้การผลิตผลิตภัณฑ์ AAV ที่มีคุณภาพสูงและสม่ำเสมอมีความซับซ้อนและต้นทุนเพิ่มมากขึ้น
AAVs ในการตั้งค่าการวิจัย AAV ไม่เพียงแต่เป็นเครื่องมือสำคัญในการบำบัดด้วยยีนเท่านั้น แต่ยังเป็นเครื่องมือที่มีค่าในงานวิจัยต่างๆ อีกด้วย ความสามารถในการส่งมอบวัสดุทางพันธุกรรมอย่างแม่นยำและมีประสิทธิภาพทำให้ AAV มีความจำเป็นสำหรับวิศวกรรมพันธุกรรม การแสดงออกของทรานส์เจนิก และการสร้างแบบจำลองน็อคเอาต์ นอกจากนี้ การผสานเทคโนโลยี CRISPR เข้ากับ AAV ยังปฏิวัติวงการการวิจัยทางพันธุกรรมอีกด้วย
วิศวกรรมพันธุกรรมและการแสดงออกทรานส์เจนิก AAV ถูกนำมาใช้กันอย่างแพร่หลายในวิศวกรรมพันธุกรรมเพื่ออำนวยความสะดวกในการแสดงออกของทรานส์ยีนในทั้งสอง ในหลอดทดลอง และ ในร่างกาย การตั้งค่า นักวิจัยใช้เวกเตอร์ AAV เพื่อนำยีนใหม่เข้าสู่สิ่งมีชีวิต ช่วยให้สามารถศึกษาการทำงานของยีน ปฏิสัมพันธ์ของโปรตีน และผลกระทบของการดัดแปลงพันธุกรรมต่อฟีโนไทป์ ประโยชน์ของการใช้ AAV สำหรับการแสดงออกทางทรานส์เจนิก ได้แก่:
ประสิทธิภาพสูง :AAV สามารถถ่ายทอดยีนได้หลากหลายประเภท ส่งผลให้มีการแสดงออกของทรานส์ยีนในระดับสูงการแสดงออกในระยะยาว :เมื่อส่งมอบแล้ว ทรานส์ยีนจะยังคงอยู่ในนิวเคลียสของเซลล์โฮสต์แบบเอพิโซม ช่วยให้แสดงออกได้อย่างยั่งยืนโดยไม่มีความเสี่ยงที่เกี่ยวข้องกับการรวมแบบสุ่มภูมิคุ้มกันต่ำ :โดยทั่วไปแล้ว AAV จะสามารถทนต่อสิ่งมีชีวิตโฮสต์ได้ดี ซึ่งช่วยลดโอกาสของการตอบสนองทางภูมิคุ้มกันที่อาจส่งผลต่อผลการวิจัยได้
ความสามารถนี้ช่วยอำนวยความสะดวกในการสร้างแบบจำลองสัตว์ที่เลียนแบบโรคของมนุษย์ ซึ่งจะทำให้ได้ข้อมูลเชิงลึกที่สำคัญเกี่ยวกับกลไกของโรคและการแทรกแซงการรักษาที่มีศักยภาพ
AAV ในโมเดลน็อคเอาท์และแอปพลิเคชัน CRISPR AAV มีบทบาทสำคัญในการสร้างแบบจำลองน็อกเอาต์เพื่อศึกษาการทำงานของยีนโดยส่งมอบเครื่องมือเช่น CRISPR/Cas9 ไปยังเป้าหมายยีนที่เฉพาะเจาะจง แบบจำลองน็อกเอาต์ช่วยให้นักวิจัยสามารถปิดใช้งานยีน ทำให้ได้รับข้อมูลเชิงลึกเกี่ยวกับการทำงานของยีน ปฏิสัมพันธ์ทางพันธุกรรม และเป้าหมายการบำบัดที่เป็นไปได้
นักวิจัยสามารถนำ Cas9 และ RNA นำทาง (gRNA) มาใช้เพื่อกระตุ้นให้เกิดการแตกหักของสายคู่ที่ยีนเป้าหมายได้ โดยการผสมผสาน AAV กับเทคโนโลยี CRISPR ข้อผิดพลาดที่เกิดขึ้นระหว่างกระบวนการซ่อมแซมจะกำจัดยีนที่น่าสนใจได้อย่างมีประสิทธิภาพ ช่วยให้นักวิจัยสามารถตรวจสอบหน้าที่และผลกระทบของยีนได้
การทำงานร่วมกันระหว่าง AAV และ CRISPR ได้เปิดขอบเขตใหม่ในด้านการวิจัยทางพันธุกรรมโดยทำให้สามารถแก้ไขยีนในสิ่งมีชีวิตได้อย่างตรงเป้าหมายและมีประสิทธิภาพ การรวมกันนี้ให้ข้อดีหลายประการ:
การตัดแต่งยีนแบบกำหนดเป้าหมาย: AAV ที่ออกแบบมาสำหรับเนื้อเยื่อเฉพาะช่วยให้นักวิจัยสามารถส่งส่วนประกอบ CRISPR ไปยังตำแหน่งที่สนใจได้อย่างแม่นยำ โดยลดผลกระทบนอกเป้าหมายให้เหลือน้อยที่สุดความสามารถในการมัลติเพล็กซ์: AAV สามารถส่งมอบ gRNA หลายตัวพร้อมกัน ทำให้สามารถลบหรือปรับเปลี่ยนยีนหลายตัวได้ในคราวเดียว ซึ่งถือเป็นแนวทางที่มีค่าสำหรับการศึกษาลักษณะทางพันธุกรรมหรือโรคที่ซับซ้อนใน Vivo การใช้งาน: การใช้ AAV เพื่อส่งมอบส่วนประกอบ CRISPR ในร่างกาย ช่วยให้การตัดต่อยีนในสิ่งมีชีวิตเป็นไปได้ง่ายขึ้น ช่วยเพิ่มความเข้าใจเกี่ยวกับการทำงานของยีน และขยายความเป็นไปได้ในการพัฒนาการบำบัดด้วยการใช้โมเดลน็อกเอาต์และแอพพลิเคชั่นการตัดแต่งยีน AAV ที่รวมกับเทคโนโลยี CRISPR กำลังปฏิวัติการวิจัยทางพันธุกรรมและปูทางไปสู่กลยุทธ์การรักษาใหม่ๆ
สรุป AAV เป็นแพลตฟอร์มที่มีความยืดหยุ่นและมีแนวโน้มดีสำหรับการบำบัดด้วยยีนและการวิจัยทางพันธุกรรม ลักษณะเฉพาะ เช่น การแสดงออกของยีนในระยะยาว ภูมิคุ้มกันต่ำ และความสามารถในการกำหนดเป้าหมายเนื้อเยื่อต่างๆ ได้ทำให้ AAV กลายเป็นรากฐานสำคัญในการพัฒนาการบำบัดแบบใหม่สำหรับโรคทางพันธุกรรม โรคทางระบบประสาท และอื่นๆ
เมื่อการวิจัยดำเนินไป การผสานรวม AAV เข้ากับเทคโนโลยีล้ำสมัย เช่น CRISPR ช่วยเพิ่มความสามารถของเราในการศึกษาการทำงานของยีนและพัฒนาวิธีการรักษาที่มีประสิทธิภาพ อย่างไรก็ตาม ความท้าทายที่เกี่ยวข้องกับภูมิคุ้มกันที่มีอยู่ก่อน ข้อจำกัดด้านความสามารถในการถ่ายยีน ความซับซ้อนของการขยายขนาดการผลิต AAV และพิษต่อพันธุกรรมที่อาจเกิดขึ้น จำเป็นต้องได้รับการพิจารณาอย่างรอบคอบและดำเนินการวิจัยอย่างต่อเนื่องเพื่อปรับให้แอปพลิเคชัน AAV เหมาะสมที่สุด
นักวิทยาศาสตร์และแพทย์พร้อมที่จะเปิดช่องทางใหม่ในการทำความเข้าใจกระบวนการทางชีววิทยาที่ซับซ้อนและพัฒนากลยุทธ์การรักษาที่สร้างสรรค์ ด้วยการรับมือกับความท้าทายเหล่านี้และใช้ประโยชน์จากจุดแข็งของ AAV อนาคตของ AAV ทั้งในการวิจัยและทางคลินิกนั้นสดใส โดยมีศักยภาพที่จะเปลี่ยนแปลงภูมิทัศน์ของการแพทย์ทางพันธุกรรม
อ้างอิง:
Batty, Paul; Lillicrap, David. Hemophilia Gene Therapy: Approaching the First Licensed Product. HemaSphere 5(3):p e540, มีนาคม 2021 | DOI: 10.1097/HS9.0000000000000540
Colella P, Ronzitti G, Mingozzi F. ปัญหาใหม่ที่เกิดขึ้นใน AAV-Mediated ในร่างกาย ยีนบำบัด วิธีการ Mol Ther คลินิก Dev . 2017;8:87-104. เผยแพร่เมื่อวันที่ 2017 ธันวาคม 1 doi:10.1016/j.omtm.2017.11.007
Hastie E, Samulski RJ. ไวรัสที่เกี่ยวข้องกับอะดีโนในวัย 50 ปี: วันครบรอบทองของการค้นพบ การวิจัย และความสำเร็จของยีนบำบัด–มุมมองส่วนบุคคล Hum Gene Ther. 2015 พ.ค.;26(5):257-65. doi: 10.1089/hum.2015.025. Epub 2015 เม.ย. 20 PMID: 25807962; PMCID: PMC4442590
Large, EE; Silveria, MA; Zane, GM; Weerakoon, O.; Chapman, MS การส่งมอบยีน Adeno-Associated Virus (AAV): การแยกปฏิกิริยาทางโมเลกุลเมื่อเซลล์เข้าสู่ร่างกาย ไวรัส 2021 , 13 , 1336 https://doi.org/10.3390/v13071336
Naso, MF, Tomkowicz, B., Perry, WL เอตอัล อะดีโนไวรัสที่เกี่ยวข้อง (AAV) เป็นเวกเตอร์สำหรับยีนบำบัด ไบโอดรักส์ 31 , 317–334 (2017). https://doi.org/10.1007/s40259-017-0234-5
วัง, JH., Gessler, ดีเจ, Zhan, W. เอตอัล ไวรัสที่เกี่ยวข้องกับอะดีโนเป็นเวกเตอร์นำส่งสำหรับยีนบำบัดโรคของมนุษย์ Sig Transduct เป้าหมาย Ther 9 , 78 (2024) https://doi.org/10.1038/s41392-024-01780-w
Wang D, Zhang F, Gao G. การแก้ไขจีโนมเพื่อการรักษาตาม CRISPR: กลยุทธ์และการส่งมอบ In Vivo โดย AAV Vectors เซลล์ . 2020;181(1):136-150. doi:10.1016/j.cell.2020.03.023