สรุป
สาขาการรักษาโรคมะเร็งกำลังอยู่ระหว่างการเปลี่ยนแปลง โดยได้รับแรงหนุนจากแนวโน้มต่อไปนี้: MSC ที่ได้มาจาก iPSC, EV ที่ได้มาจาก MSC และการแก้ไขยีนที่ใช้สื่อกลาง Cas9 ใน MSC MSC ที่ได้จาก iPSC นำเสนอแหล่งเซลล์ที่ได้มาตรฐานและปรับขนาดได้ ซึ่งเอาชนะข้อจำกัดที่เกี่ยวข้องกับวิธีการเก็บเกี่ยวแบบดั้งเดิม EV ที่ได้มาจาก MSC กลายเป็นเครื่องมือในการรักษาแบบไร้เซลล์ที่มีแนวโน้มดี โดยแสดงความสามารถในการจัดส่งยาแบบกำหนดเป้าหมายและภูมิคุ้มกันต่ำ ในขณะเดียวกัน การแก้ไขยีนที่ใช้สื่อกลาง Cas9 ช่วยให้สามารถควบคุมพฤติกรรม MSC ได้อย่างแม่นยำ และเพิ่มประสิทธิภาพในการรักษา นวัตกรรมเหล่านี้ร่วมกันขับเคลื่อนสนามไปข้างหน้า โดยเปิดช่องทางสำหรับการรักษาโรคมะเร็งเฉพาะบุคคล มีประสิทธิผล และปลอดภัยยิ่งขึ้น StemCell Express กำลังก้าวเดินบนเส้นทางแห่งความก้าวหน้าอย่างแท้จริง โดยนำความหวังสำหรับอนาคตที่สดใสในการต่อสู้กับโรคมะเร็ง
สเต็มเซลล์กลายเป็นผู้มีบทบาทสำคัญในการพัฒนายีนและเซลล์บำบัดเพื่อรักษาโรคมะเร็ง โดยมีศักยภาพมหาศาลในการจัดการกับความซับซ้อนของโรคนี้ เซลล์ต้นกำเนิดหลายชนิด รวมถึงเซลล์ต้นกำเนิดเม็ดเลือด (HSCs), เซลล์ต้นกำเนิดพลูริโพเทนต์ที่ถูกเหนี่ยวนำ (iPSCs) และเซลล์ต้นกำเนิดมีเซนไคมัล สโตรมัล/สเต็มเซลล์ (MSCs) ถูกนำมาใช้ในการบำบัดด้วยเซลล์ด้วยผลลัพธ์ที่น่าหวัง เซลล์สารพัดประโยชน์เหล่านี้สามารถควบคุมเพื่อส่งมอบยีนที่ใช้รักษาได้ โดยนำเสนอวิธีการต่อสู้กับเนื้องอกที่ตรงเป้าหมายและแม่นยำ นอกจากนี้ สเต็มเซลล์ยังแสดงคุณสมบัติที่เป็นเอกลักษณ์ รวมถึงความสามารถในการปรับระบบภูมิคุ้มกัน ทำให้เป็นทรัพย์สินที่มีคุณค่าในการเสริมสร้างการป้องกันตามธรรมชาติของร่างกายต่อโรคมะเร็ง
ในบรรดาสเต็มเซลล์ประเภทต่างๆ MSC มีความโดดเด่นในฐานะตัวเลือกที่มีแนวโน้มดีเป็นพิเศษ MSC ได้รับการออกแบบทางวิศวกรรมและมีความสามารถในการกลับบ้านไปยังบริเวณที่เป็นเนื้องอก โดยนำเสนอข้อได้เปรียบสองประการด้วยการส่งมอบน้ำหนักบรรทุกในการรักษาและส่งเสริมการตอบสนองทางภูมิคุ้มกันต่อเซลล์มะเร็ง การบูรณาการ MSC เข้ากับกลยุทธ์การบำบัดด้วยยีนและเซลล์ ถือเป็นศักยภาพในการปรับกระบวนทัศน์การรักษาโรคมะเร็ง โดยนำเสนอโซลูชั่นแปลกใหม่และเป็นส่วนตัวสำหรับผู้ป่วย
รับข้อมูลอัปเดตเกี่ยวกับแนวโน้มและความก้าวหน้าที่กำลังจะเกิดขึ้นในการใช้ MSC สำหรับการรักษาโรคมะเร็งผ่านซีรีส์ Stem Cell Express
1. การควบคุมศักยภาพของ MSC ที่ได้มาจาก iPSC
MSC ที่ใช้ในการทดลองทางคลินิกปัจจุบันมีที่มาจากเนื้อเยื่อไขมัน สายสะดือ หรือไขกระดูกเป็นหลักโดยผ่านกระบวนการรุกราน ความสามารถในการขยายที่มีข้อจำกัดของ MSC จำเป็นต้องมีขั้นตอนการแยกซ้ำๆ เพื่อตอบสนองความต้องการของการบำบัดด้วยเซลล์ ควบคู่ไปกับค่าใช้จ่ายสูงที่เกี่ยวข้องกับ ในหลอดทดลอง การขยายตัว การจำกัดการเข้าถึงทางคลินิกและการนำไปใช้อย่างแพร่หลาย วิธีการแบบดั้งเดิม ซึ่งมีศักยภาพในการเพิ่มจำนวนที่จำกัด และความแปรปรวนระหว่างผู้บริจาค ส่งผลให้เกิดผลการทดลองทางคลินิกที่ไม่สอดคล้องกัน
การระบุแหล่งที่มาของผู้บริจาคที่เหมาะสมหรือการสำรวจวิธีการทางเลือกสำหรับการผลิต MSC มีความสำคัญอย่างยิ่งในการแก้ไขคอขวดที่มีอยู่ซึ่งเป็นอุปสรรคต่อการผลิต MSC ขนาดใหญ่
iPSC เป็นตัวแทนของความก้าวหน้าทางการปฏิวัติในด้านเวชศาสตร์ฟื้นฟู โดยมีศักยภาพในการสร้างเซลล์ประเภทต่างๆ เพื่อวัตถุประสงค์ในการรักษาโรค iPSC มีความสามารถในการต่ออายุตัวเอง การเพิ่มจำนวน และความสามารถในการสร้างความแตกต่างให้กับเมโซเดิร์ม เอ็นโดเดิร์ม และเอคโทเดิร์มในระดับสูง โดยข้ามข้อกังวลด้านจริยธรรมที่เกี่ยวข้องกับเซลล์ต้นกำเนิดจากตัวอ่อน (ESC) ในบรรดาเชื้อสายของเซลล์ต่างๆ ที่ iPSC สามารถสร้างได้ MSC ก็กลายเป็นประชากรเซลล์ที่มีคุณค่าอย่างยิ่ง
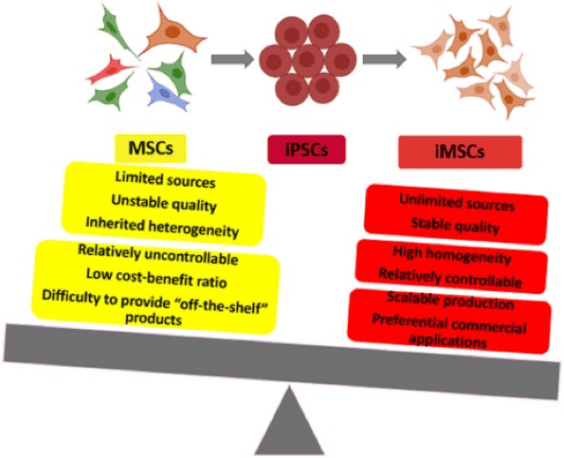
ข้อดีของการใช้ MSC ที่ได้มาจาก iPSC อยู่ที่การเอาชนะข้อจำกัดที่เกี่ยวข้องกับการเก็บเกี่ยว MSC จากเนื้อเยื่อของผู้ใหญ่ รวมถึงขั้นตอนที่รุกรานและผลผลิตของเซลล์ที่จำกัด MSC ที่ได้จาก iPSC สามารถสร้างขึ้นได้ในปริมาณมาก โดยให้แหล่งเซลล์ที่สม่ำเสมอและขยายได้ นอกจากนี้ เซลล์เหล่านี้ยังสามารถแก้ไขปัญหาที่เกี่ยวข้องกับความแปรปรวนของผู้บริจาคและการเปลี่ยนแปลงที่เกี่ยวข้องกับอายุ ทำให้ได้ผลิตภัณฑ์เซลล์ที่ได้มาตรฐานและเชื่อถือได้มากขึ้น ต้นกำเนิดที่หลากหลายของ iPSC ช่วยเพิ่มความสามารถในการขยายขนาดและการทำซ้ำสำหรับการใช้งานด้านการรักษา โดยเฉพาะอย่างยิ่ง MSC ที่ได้มาจาก iPSC นั้นมีความคล้ายคลึงกับ MSC ที่ได้มาจากเนื้อเยื่ออย่างใกล้ชิดในด้านสัณฐานวิทยา อิมมูโนฟีโนไทป์ และความสามารถในการสร้างความแตกต่างแบบสามสายเลือด ในขณะที่แสดงความสามารถในการงอกใหม่ที่แข็งแกร่งขึ้นในแบบจำลองโรคของสัตว์
ในปี 2017 Cynata Therapeutics ได้ทำการทดลองระยะที่ 1 อย่างเป็นทางการครั้งแรกของโลก (หมายเลข NCT02923375) ของผลิตภัณฑ์เซลล์ที่ได้มาจาก iPSC แบบอัลโลจีนิก (CYP-001) ในผู้ใหญ่ที่เป็นโรคเฉียบพลันต่อโฮสต์ที่ดื้อต่อสเตียรอยด์ (SR) (aGVHD) การทดลองแสดงให้เห็นว่า ภายในกลุ่มตัวอย่างจำนวนจำกัดที่มี SR-aGVHD CYP-001 มีความปลอดภัยและทนได้ แม้ว่าการทดลองเพิ่มเติมด้วยขนาดตัวอย่างที่ใหญ่ขึ้นนั้นเป็นสิ่งจำเป็นเพื่อยืนยันประสิทธิภาพ แต่การตอบสนองของ aGvHD ที่สังเกตได้ก็ให้กำลังใจ โดยปูทางไปสู่การใช้ MSC ที่ได้มาจาก iPSC ในการรักษาโรคต่างๆ โดยสรุป ผลลัพธ์ที่น่าหวังของการทดลองบ่งชี้ว่า MSC ที่ได้รับจาก iPSC ไม่เพียงแต่แสดงให้เห็นถึงความปลอดภัยและความทนทานในการรักษาโรคกราฟต์เฉียบพลันเมื่อเทียบกับโฮสต์ (SR-aGVHD) ที่ดื้อต่อสเตียรอยด์ แต่ยังเปิดโลกทัศน์ใหม่สำหรับการประยุกต์ใช้ในการรักษาโรคมะเร็งอีกด้วย ด้วยศักยภาพในการผลิตขนาดใหญ่ของผลิตภัณฑ์ 'ที่มีจำหน่ายทั่วไป' ที่มีความเสถียรและยั่งยืน MSC ที่ได้มาจาก iPSC จึงถือเป็นทรัพยากรที่มีความหลากหลายและให้กำลังใจในการรับมือกับความท้าทายที่ซับซ้อนทั้งในด้านความผิดปกติทางภูมิคุ้มกันและการรักษามะเร็ง
รูปที่ 1: ข้อดีของ MSC ที่ได้มาจาก iPSC (iMSC) ดอย:10.3389/fcell.2021.716907 สัญญาอนุญาตครีเอทีฟคอมมอนส์
2. MSC-EVs: ผู้บุกเบิกการบำบัดแบบไร้เซลล์พร้อมคำมั่นสัญญาในการรักษาโรคมะเร็ง
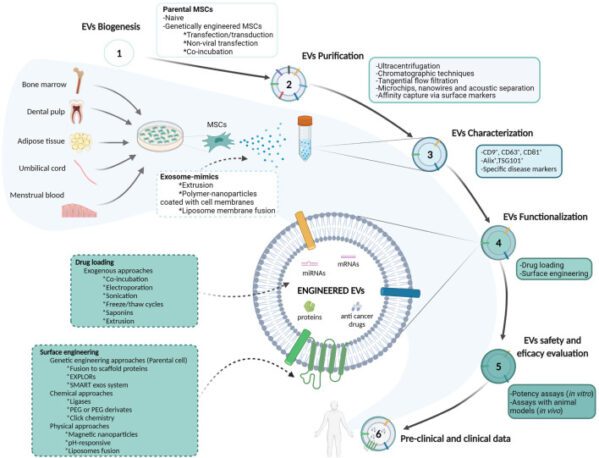
ในช่วงไม่กี่ปีที่ผ่านมา ถุงนอกเซลล์ (EV) ที่ได้มาจาก MSC ได้กลายเป็นแพลตฟอร์มที่มีแนวโน้มสำหรับการจัดส่งยา โดยใช้ประโยชน์จากความเข้ากันได้ทางชีวภาพโดยธรรมชาติและความสามารถในการจัดส่งตามเป้าหมาย ทำให้พวกมันแตกต่างจากนาโนพาริเออร์เทียม เช่น ไลโปโซม แนะนำว่าฟังก์ชันพาราครินหลายอย่างของ MSC รวมถึงการปลดปล่อยปัจจัยการเจริญเติบโต ไซโตไคน์ คีโมไคน์ และ EV มีส่วนทำให้เกิดผลการรักษา
EV สามารถจัดหมวดหมู่ตามขนาด ได้แก่ เอ็กโซโซม (30–150 นาโนเมตร) ไมโครเวซิเคิล (150–500 นาโนเมตร) และร่างกายอะพอพโทติก (800–500 นาโนเมตร) EV ที่ได้มาจาก MSC สะท้อนศักยภาพทางชีวภาพของ MSC ซึ่งเสนอทางเลือกที่ปลอดภัยกว่าการรักษาด้วยเซลล์ MSC ซึ่งอาจไวต่อการเปลี่ยนแปลงทางพันธุกรรมหรือฟีโนไทป์และการรวมตัวในหลอดเลือดขนาดเล็กของปอด
MSC-EV ด้วยเหตุผลเหล่านี้ จึงนำเสนอทางเลือกที่น่าสนใจสำหรับการบำบัดแบบไร้เซลล์ โดยเฉพาะอย่างยิ่งในด้านศักยภาพในการรักษาโรคมะเร็ง นอกเหนือจากความสามารถในการกลับบ้านที่แท้จริงและเฉพาะเป้าหมายแล้ว MSC-EV ยังปกป้องสินค้าทางชีวภาพ รวมถึง miRNA และ mRNA จากการย่อยสลาย ในร่างกาย . นอกจากนี้ MSC-EV ยังแสดงภูมิคุ้มกันที่ต่ำกว่าเมื่อเปรียบเทียบกับ MSC และสามารถดัดแปลงพันธุกรรมเพื่อเพิ่มประสิทธิภาพในการกำหนดเป้าหมายของเนื้อเยื่อ โดยทำหน้าที่เป็นพาหะที่มีประสิทธิภาพสำหรับยาต้านมะเร็งและชีววิทยา ดังนั้นจึงเอาชนะการดื้อยาในการรักษาโรคมะเร็ง
รูปที่ 2: การแสดงแผนผังของขั้นตอนการทำงานของ EVs ที่ได้มาจาก MSCs ในฐานะระบบการนำส่งยาในการรักษาโรคมะเร็ง ดอย:10.3389/fbioe.2022.882545 สัญญาอนุญาตครีเอทีฟคอมมอนส์
การทดลองทางคลินิกที่สำรวจ MSC-EV ครอบคลุมข้อบ่งชี้ที่หลากหลาย เช่น โควิด-19 เบาหวาน โรคอัลไซเมอร์ และโดยเฉพาะอย่างยิ่งการรักษาโรคมะเร็ง การทดลองระยะที่ XNUMX (NCT03608631 ) ซึ่งมุ่งเป้าไปที่การกลายพันธุ์ของ KRAS G12D ในมะเร็งตับอ่อนกำลังดำเนินการอยู่ KRAS G12D ซึ่งเป็นการกลายพันธุ์ที่พบบ่อยในมะเร็งตับอ่อน เป็นจุดสนใจของการรักษาที่มีเป้าหมายเพื่อจัดการกับการกลายพันธุ์นี้โดยเฉพาะ นักวิจัยกำลังประเมินความปลอดภัยและปริมาณที่เหมาะสมของ MSC-EVs ที่มี KrasG12D siRNA ในผู้ป่วยที่เป็นมะเร็งตับอ่อนระยะลุกลาม
แม้ว่า MSC-EV จะแสดงให้เห็นว่าเป็นเครื่องมือการรักษาแบบไร้เซลล์แบบใหม่สำหรับการรักษามะเร็งทางคลินิก แต่ความท้าทายยังคงมีอยู่ โปรโตคอลที่เป็นมาตรฐานสำหรับการแยกและการกำหนดลักษณะของ MSC-EV ที่ต่างกันนั้นมีความจำเป็น ข้อกังวลด้านความปลอดภัยและประสิทธิภาพเกิดขึ้นเนื่องจากคุณสมบัติในการส่งเสริมเนื้องอกที่บันทึกไว้ การเคลื่อนตัวภายในโดยเซลล์อื่น และการกวาดล้างโดยมาโครฟาจ MSC-EV จากธรรมชาติที่ให้ผลผลิตต่ำและประสิทธิภาพในการส่งยาที่จำกัด ตอกย้ำความจำเป็นในการศึกษาพรีคลินิกและทางคลินิกเพิ่มเติม เพื่อขับเคลื่อนการบำบัดด้วย MSC-EV ไปสู่การประยุกต์ใช้ทางคลินิกในวงกว้าง
แม้ว่า MSC จะได้รับความสนใจอย่างกว้างขวางถึงข้อดีโดยธรรมชาติและคุณสมบัติที่เป็นประโยชน์ แต่การใช้ MSC ในรูปแบบที่สมบูรณ์ก็มีข้อจำกัดบางประการ MSC อาจไม่สามารถนำทางไปยังเนื้อเยื่อหรือเนื้องอกเป้าหมายที่เฉพาะเจาะจงได้อย่างมีประสิทธิภาพ โดยจำกัดความสามารถในการส่งสารรักษาโรคไปยังตำแหน่งที่ออกฤทธิ์อย่างแม่นยำ นอกจากนี้ เซลล์เหล่านี้อาจแสดงระยะเวลาที่จำกัดของการคงอยู่ในร่างกายหลังการให้ยา โดยจำเป็นต้องให้ยาซ้ำเพื่อให้ผลการรักษาที่ยั่งยืน ความกังวลยังเกิดขึ้นเกี่ยวกับศักยภาพของ MSC เมื่อได้รับการดูแลโดยสมบูรณ์ เพื่อสร้างความแตกต่างเป็นประเภทเซลล์ที่ไม่ได้ตั้งใจ หรือแสดงพฤติกรรมที่คาดเดาไม่ได้ ในร่างกาย โดยเน้นย้ำถึงความจำเป็นในการควบคุมการกระทำของพวกเขาอย่างแม่นยำ
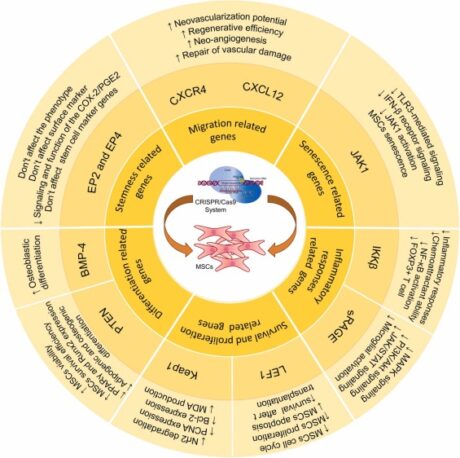
เพื่อเอาชนะความท้าทายเหล่านี้ แนะนำให้ใช้วิธีการต่างๆ เพื่อเพิ่มประสิทธิภาพ MSC ผ่านการดัดแปลงทางพันธุกรรม เทคนิคหลายประการ รวมถึงเวกเตอร์ของไวรัส (เวกเตอร์เลนติไวรัส/เวกเตอร์อะดีโนไวรัส), การเปลี่ยนพลาสมิด, อิเล็กโตรโพเรชัน, ทรานโพซอน, การนำส่งโดยใช้อนุภาคนาโน และเทคโนโลยี CRISPR/Cas9 ที่ปฏิวัติวงการ ถูกนำมาใช้เพื่อจุดประสงค์นี้
ในบรรดาวิธีการเหล่านี้ CRISPR/Cas9 มีความโดดเด่นในฐานะเครื่องมือแก้ไขยีนที่มีประสิทธิภาพสูงซึ่งเป็นที่ยอมรับอย่างกว้างขวางในชุมชนวิทยาศาสตร์ การประยุกต์ใช้ทางคลินิกครั้งแรก การอนุมัติ ในสหราชอาณาจักรสำหรับการรักษาโรคเคียวเซลล์และเบต้าธาลัสซีเมีย (TDT) ที่ขึ้นอยู่กับการถ่ายเลือด ได้ปูทางไปสู่การจัดการกับโรคต่างๆ ในการรักษาโรคมะเร็ง CRISPR/Cas9 มีความโดดเด่นในด้านเซลล์ภูมิคุ้มกันที่ได้รับการดัดแปลงพันธุกรรม โดยเฉพาะทีเซลล์ เพื่อเสริมประสิทธิภาพในการต่อสู้กับเนื้องอก
คุณสมบัติที่โดดเด่นอย่างหนึ่งของ CRISPR/Cas9 คือความสามารถในการกำหนดเป้าหมายลำดับยีนหลายลำดับพร้อมกัน ทำให้เป็นตัวเลือกที่คุ้มค่ากว่าเมื่อเปรียบเทียบกับเทคโนโลยีการแก้ไขยีนอื่นๆ แอปพลิเคชันของ MSC ที่แก้ไขด้วย CRISPR/Cas9 นั้นมีความหลากหลาย รวมถึงการรักษาต้นกำเนิดของ MSC ลดการชราภาพและการตายของเซลล์ของ MSC และเพิ่มความอยู่รอดของ MSC และคุณสมบัติการปรับภูมิคุ้มกัน การปรับเปลี่ยนแต่ละครั้งมีเป้าหมายเชิงกลยุทธ์เพื่อยกระดับประสิทธิภาพการรักษาของ MSC ผลลัพธ์ของวิศวกรรม CRISPR/Cas9 ในการศึกษา MSC สรุปไว้ในรูปที่ 3 โดยเน้นถึงศักยภาพในการเปลี่ยนแปลงของเครื่องมือแก้ไขยีนนี้ในการพัฒนาขีดความสามารถในการรักษาของ MSC
รูปที่ 3: แตกต่าง คุณลักษณะของ MSC ที่ออกแบบโดย CRISPR/Cas9 ดอย:10.1016/j.biopha.2022.113943 สัญญาอนุญาตครีเอทีฟคอมมอนส์
อ้างอิง
อับดาล ดาเยม เอ, ลี เอสบี, คิม เค, ลิม KM, จอน ทีไอ, ซอก เจ, โช อาส การผลิตเซลล์ต้นกำเนิดมีเซนไคมัลผ่านการเขียนโปรแกรมเซลล์ต้นกำเนิดใหม่ Int J โมลวิทย์ 2019 18 เม.ย.;20(8):1922. ดอย: 10.3390/ijms20081922. PMID: 31003536; PMCID: PMC6514654.
Bloor AJC, Patel A, Griffin JE และคณะ การผลิต ความปลอดภัย และประสิทธิภาพของเซลล์ mesenchymal stromal ที่ได้มาจาก iPSC ในการปลูกถ่ายอวัยวะที่ดื้อต่อสเตียรอยด์แบบเฉียบพลันกับโรคเจ้าบ้าน: การศึกษาระยะที่ 2020 แบบหลายศูนย์ แบบเปิดฉลาก และการเพิ่มขนาดยา แนท เมด. 26;11(1720):1725-10.1038. ดอย:41591/s020-1050-XNUMX-x
Dalmizrak A, Dalmizrak O. Exosome ที่ได้มาจากเซลล์ต้นกำเนิด Mesenchymal เป็นเครื่องมือใหม่สำหรับการส่ง miRNAs ในการรักษามะเร็ง ฟรอนท์ ไบโอเอ็น ไบโอเทคโนล . 2022;10:956563. เผยแพร่เมื่อ 2022 กันยายน 26 ดอย:10.3389/fbioe.2022.956563
Golchin A, Shams F, Karami F. การพัฒนาเซลล์ต้นกำเนิดจาก Mesenchymal ด้วย CRISPR/Cas9 สำหรับการศึกษาทดลองทางคลินิก Adv Exp Med Biol. 2020;1247:89-100. ดอย:10.1007/5584_2019_459
ฮาซราติ เอ, มาเล็คปูร์ เค, ซูดี เอส, ฮาเชมี เอสเอ็ม สโตรมอล/สเต็มเซลล์แบบมีเซนไคมัลที่ออกแบบโดย CRISPR/Cas9 และถุงน้ำนอกเซลล์: แนวทางใหม่ในการเอาชนะข้อจำกัดในการบำบัดด้วยเซลล์ เภสัชชีวเวช. 2022;156:113943. ดอย:10.1016/j.biopha.2022.113943
Lotfy A, AboQuella NM, Wang H. Mesenchymal stromal/สเต็มเซลล์ (MSC) ได้มาจาก exosomes ในการทดลองทางคลินิก สเต็มเซลล์เรสเธอ 2023;14(1):66. เผยแพร่เมื่อ 2023 เมษายน 7. doi:10.1186/s13287-023-03287-7
Phelps J, Sanati-Nezhad A, Ungrin M, Duncan NA, Sen A. การประมวลผลทางชีวภาพของเซลล์ต้นกำเนิดจาก Mesenchymal และอนุพันธ์: สู่การบำบัดแบบไร้เซลล์ สเต็มเซลล์อินเตอร์ . 2018;2018:9415367. เผยแพร่เมื่อ 2018 กันยายน 12. doi:10.1155/2018/9415367
ซานมาร์ติน เอ็มซี, บอร์โซน FR, จิโอเรลโล เอ็มบี, ยานนาเรลลี จี, เชสซิง เอ็นเอ ถุงน้ำนอกเซลล์ที่ได้มาจากเซลล์ Mesenchymal Stromal เป็นตัวพาทางชีวภาพสำหรับการนำส่งยาในการรักษาโรคมะเร็ง ฟรอนท์ ไบโอเอ็น ไบโอเทคโนล . 2022;10:882545. เผยแพร่เมื่อ 2022 เมษายน 14 ดอย:10.3389/fbioe.2022.882545
Shan C, Liang Y, Wang K, Li P. ถุงนอกเซลล์ที่ได้มาจากเซลล์ต้นกำเนิด Mesenchymal ในการต้านทานการรักษาโรคมะเร็ง: จากชีววิทยาไปจนถึงโอกาสทางคลินิก Int J Biol วิทย์ 2024;20(1):347-366. เผยแพร่เมื่อ 2024 ม.ค. 1. doi:10.7150/ijbs.88500
จาง เจ, เฉิน เอ็ม, เหลียว เจ และคณะ เซลล์ต้นกำเนิดมีเซนไคมอลที่ได้มาจากเซลล์ต้นกำเนิด Pluripotent เหนี่ยวนำให้เกิดความหลากหลายที่ต่ำกว่าและมีแนวโน้มที่ดีเยี่ยมในการวิจัยทางชีววิทยาและการประยุกต์ใช้ทางคลินิก ฟรอนต์เซลล์ เดฟ ไบโอล . 2021;9:716907. Published 2021 Sep 30. doi:10.3389/fcell.2021.716907 เผยแพร่เมื่อ XNUMX กันยายน XNUMX. doi:XNUMX/fcell.XNUMX