- 장바구니가 비어 있습니다
- 쇼핑 계속하기
기질 강성이 중간엽 줄기 세포의 행동을 어떻게 형성하는지 이해하기
미래는 유연합니다: 요약 기질 강성은 MSC 행동의 중요한 결정 요인으로 작용하여 접착, 증식, 이동 및 분화에 중대한 영향을 미칩니다. 이해
암 치료 분야는 iPSC 유래 MSC, MSC 유래 EV 및 MSC의 Cas9 매개 유전자 편집이라는 추세에 따라 혁신적인 변화를 겪고 있습니다. iPSC 유래 MSC는 확장 가능하고 표준화된 세포 공급원을 제공하여 기존 수확 방법과 관련된 한계를 극복합니다. MSC 유래 EV는 표적 약물 전달 능력과 낮은 면역원성을 나타내는 유망한 무세포 치료 도구로 부상하고 있습니다. 한편 Cas9 매개 유전자 편집은 MSC 행동을 정밀하게 제어하여 치료 효율성을 향상시킵니다. 이러한 혁신은 함께 이 분야를 발전시켜 맞춤화되고 효과적이며 안전한 암 치료를 위한 길을 열어줍니다. StemCell Express는 진정으로 진보의 궤도를 타고 암과의 싸움에서 더 밝은 미래에 대한 희망을 가져오고 있습니다.
줄기 세포는 암 치료를 위한 유전자 및 세포 치료의 진화하는 환경에서 중추적인 역할을 하고 있으며, 이 질병의 복잡성을 해결할 수 있는 엄청난 잠재력을 가지고 있습니다. 조혈줄기세포(HSC), 유도만능줄기세포(iPSC), 중간엽 간질/줄기세포(MSC)를 포함한 다양한 줄기세포가 세포치료에 사용되어 유망한 결과를 얻었습니다. 이러한 다재다능한 세포는 치료 유전자를 전달하는 데 활용될 수 있으며 종양과 싸우기 위한 표적화되고 정확한 접근 방식을 제공합니다. 더욱이, 줄기세포는 면역 체계를 조절하는 능력을 포함하여 독특한 특성을 나타내므로 암에 대한 신체의 자연 방어력을 강화하는 데 귀중한 자산이 됩니다.
다양한 줄기 세포 유형 중에서 MSC는 특히 유망한 후보로 두드러집니다. 엔지니어링이 가능하고 종양 부위로 이동할 수 있는 MSC는 치료 페이로드를 전달하고 암세포에 대한 면역 반응을 촉진함으로써 이중 이점을 제공합니다. MSC를 유전자 및 세포 치료 전략에 통합하면 암 치료 패러다임을 재구성하여 환자를 위한 새롭고 맞춤화된 솔루션을 제공할 수 있는 잠재력이 있습니다.
Stem Cell Express 시리즈를 통해 암 치료에 MSC를 사용하는 데 있어 향후 추세와 발전에 대한 업데이트를 받아보세요.
현재 임상 시험에 사용되는 MSC는 주로 침습적 절차를 통해 지방 조직, 탯줄 또는 골수에서 추출됩니다. MSC의 제한된 확장 능력으로 인해 세포 치료 요구 사항을 충족하기 위해서는 반복적인 분리 절차가 필요하며, 이와 관련된 높은 비용도 필요합니다. 체외에서 확장하여 임상 접근성과 광범위한 채택을 제한합니다. 제한된 증식 가능성과 기증자 간 변동성이 특징인 전통적인 방법은 일관되지 않은 임상 시험 결과를 초래합니다.
대규모 MSC 생산을 방해하는 기존 병목 현상을 해결하려면 적절한 기증자 소스를 식별하거나 MSC 생산을 위한 대체 방법론을 탐색하는 것이 중요합니다.
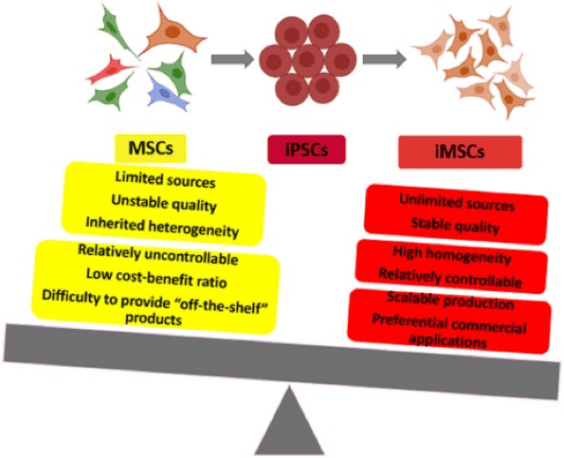
iPSC는 재생 의학의 혁명적인 발전을 나타내며 치료 목적을 위해 다양한 세포 유형을 생성할 수 있는 잠재력을 제공합니다. iPSC는 배아줄기세포(ESC)와 관련된 윤리적 우려를 우회하면서 중배엽, 내배엽 및 외배엽에 대한 높은 자가 재생 능력, 증식 및 분화 능력을 보유하고 있습니다. iPSC가 생성할 수 있는 다양한 세포 계통 중에서 MSC는 특히 귀중한 세포 집단으로 나타납니다.
iPSC 유래 MSC 사용의 장점은 침습적 절차 및 제한된 세포 수율을 포함하여 성인 조직에서 MSC를 수확하는 것과 관련된 한계를 극복하는 데 있습니다. iPSC 유래 MSC는 대량으로 생성될 수 있어 일관되고 확장 가능한 세포 공급원을 제공합니다. 또한, 이러한 세포는 기증자 변동성 및 연령 관련 변화와 관련된 문제를 잠재적으로 해결하여 보다 표준화되고 신뢰할 수 있는 세포 제품을 제공할 수 있습니다. iPSC의 다능성 기원은 치료 적용을 위한 확장성과 재현성을 향상시킵니다. 특히, iPSC 유래 MSC는 형태, 면역 표현형 및 3계통 분화 능력에서 조직 유래 MSC와 매우 유사하며, 동물 질병 모델에서는 더 강력한 재생 능력을 나타냅니다.
2017년 사이나타 테라퓨틱스(Cynata Therapeutics)는 동종 iPSC 유래 세포 제품에 대한 세계 최초의 정식 1상 시험(번호 NCT02923375)을 수행했습니다. (CYP-001) 스테로이드 내성(SR) 급성 이식편대숙주병(aGVHD)이 있는 성인의 경우. 이 시험은 제한된 수의 SR-aGVHD 대상자 내에서 CYP-001이 안전하고 내약성이 있음을 보여줍니다. 효능을 확인하기 위해서는 더 큰 표본 크기를 사용한 추가 시험이 필요하지만 관찰된 aGvHD 반응은 고무적이며 다양한 질병 치료에 iPSC 유래 MSC를 활용하는 길을 열었습니다. 요약하면, 본 시험의 유망한 결과는 iPSC 유래 MSC가 스테로이드 내성 급성 이식편대숙주병(SR-aGVHD) 치료에 있어 안전성과 내약성을 입증할 뿐만 아니라 암 치료에 적용할 수 있는 새로운 지평을 열었다는 것을 나타냅니다. 안정적이고 지속 가능한 '기성품' 제품의 대규모 생산 가능성을 갖춘 iPSC 유래 MSC는 면역 질환과 암 치료 모두의 복잡한 문제를 해결하기 위한 다재다능하고 고무적인 자원입니다.
최근 몇 년 동안 MSC에서 파생된 세포외소포(EV)는 고유한 생체 적합성과 표적 전달 능력을 활용하여 리포솜과 같은 인공 나노운반체와 차별화되는 약물 전달을 위한 유망한 플랫폼으로 부상했습니다. 성장 인자, 사이토카인, 케모카인 및 EV의 방출을 포함하여 MSC의 많은 측분비 기능이 치료 효과에 기여하는 것으로 제안됩니다.
EV는 크기에 따라 엑소솜(30~150nm), 미세소포체(150~500nm), 세포사멸체(800~500nm)로 분류될 수 있습니다. MSC 유래 EV는 MSC의 생물학적 잠재력을 반영하여 폐 미세혈관의 유전적 또는 표현형 변화 및 응집에 취약할 수 있는 MSC 세포 치료에 대한 보다 안전한 대안을 제공합니다.
MSC-EV, 이러한 이유로 무세포 치료를 달성하기 위한 흥미로운 옵션을 제시하며, 특히 암 치료에서의 잠재력으로 주목할 만합니다. MSC-EV는 본질적인 목표별 원점 복귀 기능 외에도 miRNA 및 mRNA를 포함한 생물학적 화물을 분해로부터 보호합니다. 생체내에서. 또한 MSC-EV는 MSC에 비해 면역원성이 낮고 유전자 변형을 통해 조직 표적화 효율을 향상시켜 항암제 및 생물학적 제제의 효과적인 운반체 역할을 함으로써 암 치료에서 약물 내성을 극복할 수 있습니다.
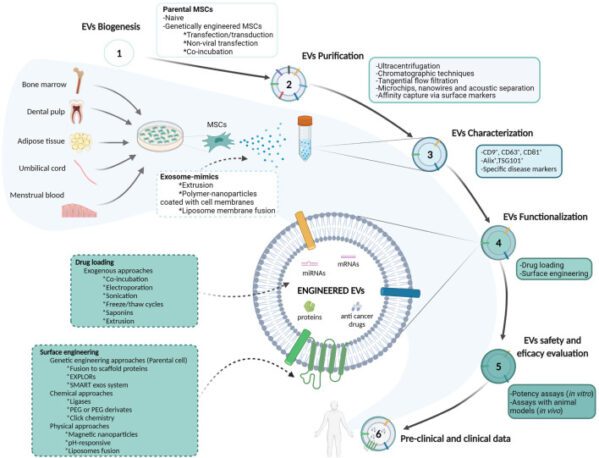
MSC-EV를 탐색하는 임상 시험은 코로나19, 당뇨병, 알츠하이머병, 특히 암 치료법과 같은 다양한 적응증을 포괄합니다. XNUMX상 임상시험(NCT03608631) 췌장암에서 KRAS G12D 돌연변이를 표적으로 하는 연구가 현재 진행 중입니다. 췌장암에서 흔한 돌연변이인 KRAS G12D는 이 돌연변이를 구체적으로 해결하는 것을 목표로 하는 치료법의 초점입니다. 연구자들은 전이성 췌장암 환자를 대상으로 KrasG12D siRNA를 탑재한 MSC-EV의 안전성과 적절한 투여량을 평가하고 있습니다.
MSC-EV는 임상 암 치료를 위한 새로운 무세포 치료 도구로서의 가능성을 보여주지만 과제는 지속됩니다. 이기종 MSC-EV의 격리 및 특성화를 위한 표준화된 프로토콜이 필수적입니다. 문서화된 종양 촉진 특성, 다른 세포에 의한 내부화 및 대식세포에 의한 제거로 인해 안전성 및 유효성에 대한 우려가 발생합니다. 천연 MSC-EV의 낮은 수율과 약물 전달의 제한된 효능은 MSC-EV 치료를 광범위한 임상 적용으로 추진하기 위한 추가 전임상 및 임상 연구가 필요함을 강조합니다.
MSC는 고유한 장점과 유익한 특성으로 인해 광범위한 주목을 받았지만, MSC를 온전한 형태로 적용하는 데에는 몇 가지 제한 사항이 있습니다. MSC는 특정 표적 조직이나 종양을 효율적으로 탐색하지 못하여 치료제를 작용 부위에 정확하게 전달하는 능력을 제한할 수 있습니다. 또한, 이들 세포는 투여 후 체내에서 제한된 지속 기간을 나타낼 수 있으므로 지속적인 치료 효과를 위해서는 반복 투여가 필요합니다. MSC가 그대로 투여될 경우 의도하지 않은 세포 유형으로 분화되거나 예측할 수 없는 행동을 보일 가능성에 대한 우려도 제기됩니다. 생체내에서, 자신의 행동에 대한 정확한 통제가 필요함을 강조합니다.
이러한 문제를 극복하기 위해 유전자 변형을 통해 MSC 효율성을 향상시키는 다양한 방법이 권장됩니다. 이러한 목적을 위해 바이러스 벡터(렌티바이러스 벡터/아데노바이러스 벡터), 플라스미드 형질감염, 전기천공, 트랜스포존, 나노입자 매개 전달 및 혁신적인 CRISPR/Cas9 기술을 포함한 여러 기술이 사용됩니다.
이러한 방법론 중에서 CRISPR/Cas9는 과학계에서 널리 채택되는 매우 효과적인 유전자 편집 도구로 돋보입니다. 첫 번째 임상 적용 승인 영국에서는 겸상 적혈구 질환과 수혈 의존성 베타 지중해빈혈(TDT)을 치료하기 위해 다양한 질병을 해결할 수 있는 길을 열었습니다. 암 치료에서 CRISPR/Cas9는 종양 퇴치 효과를 강화하기 위해 면역 세포, 특히 T 세포를 유전적으로 조작하는 데 있어 두각을 나타내고 있습니다.
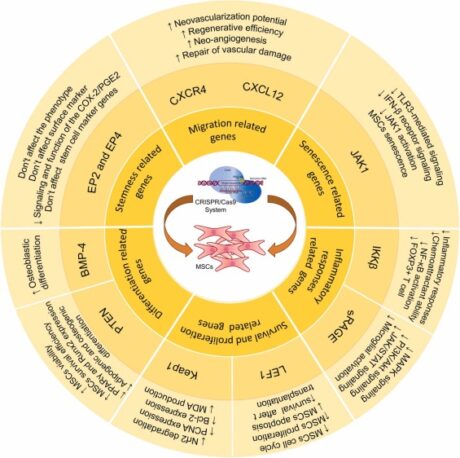
CRISPR/Cas9의 독특한 특징 중 하나는 여러 유전자 서열을 동시에 표적으로 삼는 능력으로, 다른 유전자 편집 기술에 비해 비용 효율적인 옵션이 됩니다. CRISPR/Cas9 편집 MSC의 응용 분야는 MSC 줄기성 보존, MSC 노화 및 세포사멸 감소, MSC 생존 및 면역 조절 특성 강화 등 다양합니다. 이러한 각 변형은 MSC의 치료 효율성을 높이는 것을 전략적으로 목표로 합니다. MSC 연구에 대한 CRISPR/Cas9 엔지니어링 결과는 그림 3에 요약되어 있으며 MSC의 치료 능력을 향상시키는 데 있어 이 유전자 편집 도구의 혁신적인 잠재력을 강조합니다.
참고자료
압달다엠A, 이SB, 김K, 임KM, 전티아이, 석제이, 조 AS. 줄기세포 리프로그래밍을 통한 중간엽 줄기세포의 생산. Int J Mol Sci. 2019년 18월 20;8(1922):10.3390. 도이: 20081922/ijms31003536. PMID: 6514654; PMCID: PMCXNUMX.
Bloor AJC, Patel A, Griffin JE 등. 급성 스테로이드 내성 이식편 대 숙주 질환에서 iPSC 유래 중간엽 간질 세포의 생산, 안전성 및 효능: 제2020상, 다기관, 공개 라벨, 용량 증량 연구. Nat Med. 26;11(1720):1725-10.1038. doi:41591/s020-1050-XNUMX-x
Dalmizrak A, Dalmizrak O. 암 치료에서 miRNA 전달을 위한 새로운 도구로서의 중간엽 줄기 세포 유래 엑소좀. 프론트바이오엔지 바이오테크놀러지. 2022;10:956563. 2022년 26월 10.3389일 게시. doi:2022.956563/fbioe.XNUMX
Golchin A, Shams F, Karami F. 임상 시험 연구를 위해 CRISPR/Cas9를 사용한 중간엽 줄기 세포 치료 발전. 고급 특급 의학 Biol. 2020;1247:89-100. 도이:10.1007/5584_2019_459
Hazrati A, Malekpour K, Soudi S, Hashemi SM. CRISPR/Cas9 조작 중간엽 간질/줄기 세포 및 세포외 소포: 세포 치료 한계를 극복하기 위한 새로운 접근 방식입니다. 바이오메드파마코터. 2022;156:113943. doi:10.1016/j.biopha.2022.113943
Lotfy A, AboQuella NM, Wang H. 임상 시험 중인 중간엽 간질/줄기 세포(MSC) 유래 엑소좀. 줄기세포 Res Ther. 2023;14(1):66. 2023년 7월 10.1186일 게시. doi:13287/s023-03287-7-XNUMX
Phelps J, Sanati-Nezhad A, Ungrin M, Duncan NA, Sen A. 중간엽 줄기 세포 및 그 파생물의 생물처리: 무세포 치료제를 향하여. 줄기 세포 Int. 2018;2018:9415367. 2018년 12월 10.1155일 게시. doi:2018/9415367/XNUMX
Sanmartin MC, Borzone FR, Giorello MB, Yannarelli G, Chaseing NA. 암 치료에서 약물 전달을 위한 생물학적 운반체로서의 중간엽 간질 세포 유래 세포밖 소포체. 프론트바이오엔지 바이오테크놀러지. 2022;10:882545. 2022년 14월 10.3389일 게시. doi:2022.882545/fbioe.XNUMX
Shan C, Liang Y, Wang K, Li P. 암 치료 저항성의 중간엽 줄기세포 유래 세포밖 소포체: 생물학에서 임상 기회까지. Int J Biol Sci. 2024;20(1):347-366. 2024년 1월 10.7150일 게시. doi:88500/ijbs.XNUMX
장 J, 첸 M, Liao J, 그 외 여러분. 유도 만능 줄기 세포 유래 중간엽 줄기 세포는 생물학적 연구 및 임상 응용 분야에서 이질성이 낮고 큰 가능성을 가지고 있습니다. 프론트 셀 데브 바이올. 2021;9:716907. 2021년 30월 10.3389일 게시. doi:2021.716907/fcell.XNUMX

미래는 유연합니다: 요약 기질 강성은 MSC 행동의 중요한 결정 요인으로 작용하여 접착, 증식, 이동 및 분화에 중대한 영향을 미칩니다. 이해

임상 시험에서 중간엽 줄기 세포(MSC)의 사용이 전 세계적으로 급증하여 MSC가 가장 인기 있는 재생 세포 중 하나로 자리매김했습니다.
암 연구에서 FBS 추적성이 왜 중요한지 알아보세요. ISIA 인증과 신뢰할 수 있는 결과를 위한 신뢰할 수 있는 세럼 제품에 대해 알아보세요.

고객 관리, 영업 및 과학 지원에 문의하세요.

당사 제품 및 서비스에 대한 상담 및 질문

기술 및 안전 데이터 시트, 가이드 등의 문서화..