- 장바구니가 비어 있습니다
- 쇼핑 계속하기
혁신적인 세포 염색을 통해 암 연구를 발전시키는 5가지 방법
암 연구에 활력을 불어넣는 5가지 획기적인 세포 염색을 발견해보세요! 이러한 혁신이 어떻게 새로운 목표를 밝히고 맞춤형 의약품을 추진하는지 알아보세요.

현미경은 보이지 않는 세계를 들여다보는 우리의 눈이며, 생명과 물질의 복잡한 세부 사항을 보여줍니다. 가장 작은 미생물에서 물질의 복잡한 구조에 이르기까지, 현미경은 한때 우리의 이해 범위를 벗어난 지식의 세계를 열었습니다.
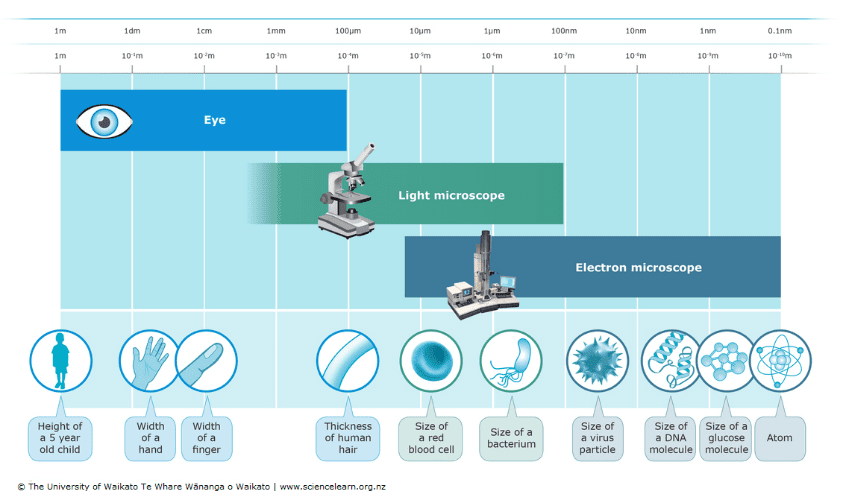
그림 1 : 육안, 광학 현미경, 전자 현미경의 분해능.
출처: 과학 학습 허브
현미경으로의 여행은 16세기 후반에 시작되었습니다. 자카리아스 얀센, 네덜란드의 안경 제작자는 최초의 복합 현미경을 만든 공로를 인정받았습니다. 이 획기적인 발명품은 오늘날 사용 가능한 다양한 기술의 기초를 마련했습니다. 이러한 기술은 사용되는 빛의 유형, 이미지가 형성되는 방식 및 특정 응용 분야에 따라 크게 다릅니다.
이 탐구에서 우리는 현미경 기술의 매혹적인 세계를 탐구하여 그 기본 원리, 역량, 한계를 밝혀낼 것입니다. 연구자들은 다양한 접근 방식의 강점과 약점을 이해함으로써 샘플에 숨겨진 비밀을 밝혀낼 최적의 기술을 선택할 수 있습니다.
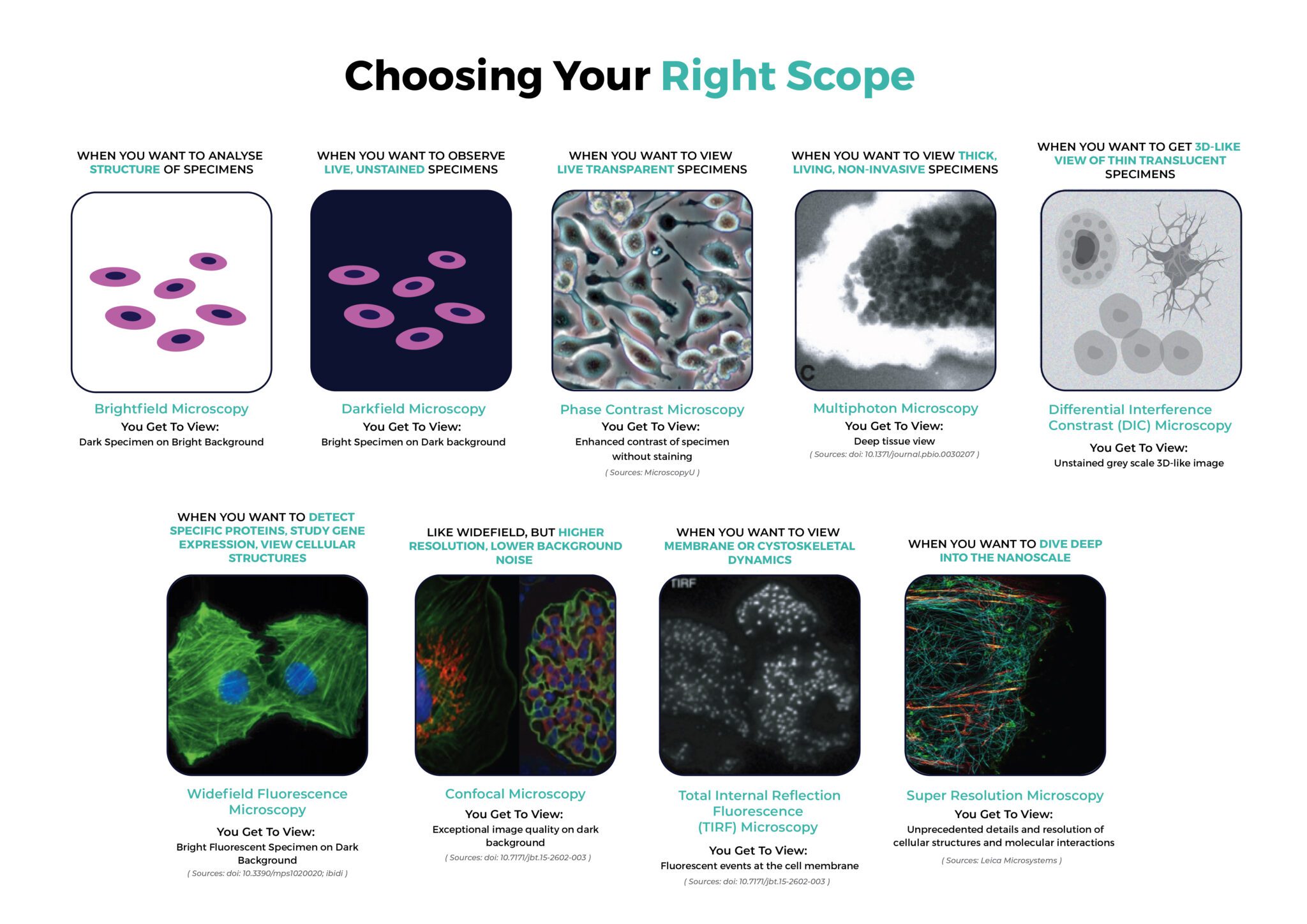
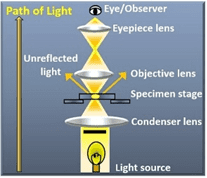
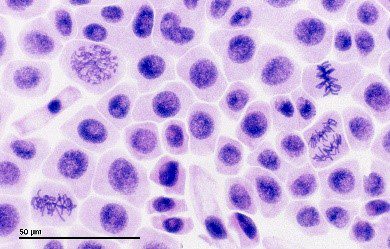
그림 2 : 명시야 현미경 광학 설정(왼쪽). 유사 분열의 다른 단계에 있는 양파 세포의 명시야 이미지(오른쪽).
브라이트필드 현미경은 현미경의 기본 기술로, 단순성과 신뢰성으로 널리 사용됩니다. 생물학과 의학에서 가장 흔한 방법 중 하나로, 다양한 샘플을 자세히 관찰할 수 있습니다.
명시야 현미경은 빛이 콘덴서에 의해 수집되어 표본을 통과하여 대물렌즈로 전달되는 기본 광학 시스템을 사용합니다. 결과적인 이미지는 표본의 빛 흡수, 반사 및 굴절로 인해 발생하는 광 강도 변화로 인해 형성됩니다. 이 대비 메커니즘은 밝은 배경에 어두운 샘플을 생성하므로 이러한 이름이 붙었습니다. 명시야 현미경은 충분한 대비를 보이는 얇고 반투명한 표본에서 가장 효과적입니다. 이 대비는 자연 색소와 같이 표본에 내재되어 있거나 염색 기술을 통해 인위적으로 향상될 수 있습니다.
명시야 현미경의 다양성은 수많은 분야에 걸쳐 있습니다. 생물학자와 의학 과학자는 이 기술을 사용하여 세포, 조직 및 미생물을 검사합니다. 재료 과학자도 명시야 현미경을 사용하여 재료의 구조를 분석합니다.
충분한 대비가 있는 샘플에는 효과적이지만, 명시야 현미경은 투명한 표본에 의해 어려움을 겪습니다. 이 기술이 세부 사항을 시각화하는 능력은 샘플과 배경 사이의 대비에 의해 제한됩니다.
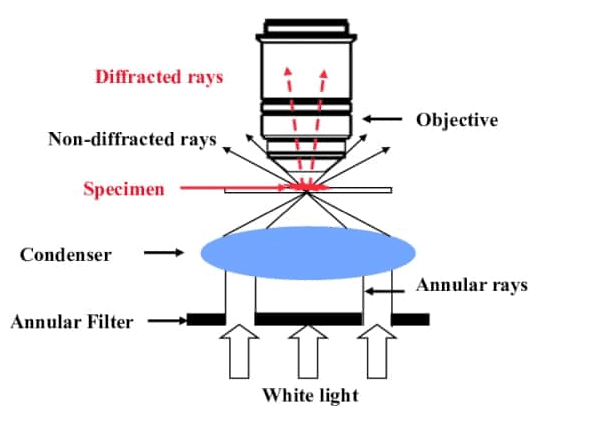

그림 3 : 암시야 현미경 광학 설정(왼쪽). 암시야 이미지 세리오다프니아 두비아 (오른쪽).
명시야 현미경과 달리 암시야 현미경은 직접 빛이 대물렌즈에 도달하지 못하도록 차단하여 인상적인 이미지를 만듭니다. 표본 자체에서 산란된 빛만 렌즈에 들어오므로 어두운 배경에 밝은 샘플이 생깁니다.
암시야 현미경은 직사광선이 표본에 도달하는 것을 차단하여 높은 대비를 이룹니다. 특수 콘덴서를 사용하면 빛이 측면에서 표본으로 향하여 중공 조명 원뿔을 만듭니다. 표본이 있으면 빛이 산란되어 대물 렌즈에 들어갑니다. 이렇게 하면 어두운 배경에 표본의 밝은 이미지가 생성되어 특히 얼룩이 지지 않고 투명한 샘플의 가시성이 향상됩니다.
암시야 현미경은 박테리아, 원생동물, 나선균과 같은 살아 있는 염색되지 않은 표본을 관찰하는 데 특히 유용합니다. 또한 재료 과학에서 작은 입자와 결함을 감지하는 데 사용됩니다. 불투명한 샘플에서 표면 구조, 불완전성 및 경계를 강조하는 데 효과적입니다.
어두운 배경은 표본 내의 미세한 세부 사항을 관찰하기 어렵게 만들 수 있으며, 먼지와 파편은 밝은 물체로 나타나 잠재적으로 표본을 가릴 수 있습니다. 또한 암시야에 필요한 높은 광도는 잠재적으로 민감한 표본을 손상시킬 수 있습니다.
위상차 현미경은 밝은 시야 현미경에 대비가 충분하지 않은 살아있는 세포와 같은 투명한 표본을 시각화하는 강력한 기술입니다. 표본 내의 다른 구조가 굴절률이 달라 빛이 다른 속도로 통과한다는 사실을 이용합니다.
특수 콘덴서와 대물렌즈를 사용하여 위상차(인간의 눈에는 보이지 않음)를 진폭차(밝기의 변화로 보임)로 변환합니다. 이렇게 하면 염색할 필요 없이 표본의 대비가 향상됩니다.
위상차 현미경은 세포 생물학에서 살아있는 세포를 연구하고, 세포 내 구조를 관찰하고, 동적 과정을 모니터링하는 데 널리 사용됩니다. 또한 미생물학에서 박테리아와 다른 미생물을 검사하는 데 사용됩니다.
위상차 이미지는 종종 구조물의 가장자리 주변에 헤일로 아티팩트를 나타내며, 이는 세부 사항을 가릴 수 있습니다. 대물렌즈의 위상 링은 명시야 현미경에 비해 전반적인 해상도를 약간 낮출 수 있습니다. 또한 표준 명시야 광학보다 특수 위상차 대물렌즈와 콘덴서가 필요하기 때문에 비용이 더 많이 듭니다.
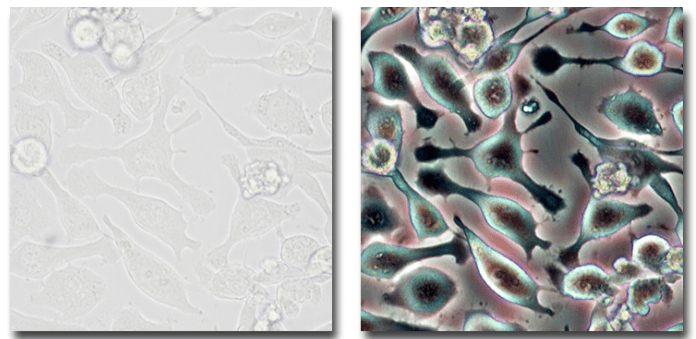
그림 4 : 명시야(왼쪽)와 위상차 촬영(오른쪽)으로 촬영한 인간 신경교세포 이미지.
출처 : 현미경U
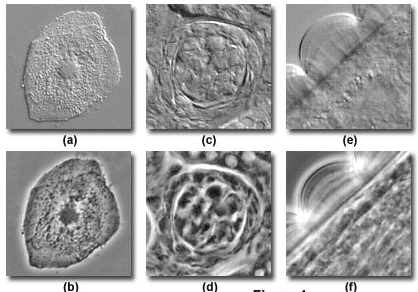
그림 5 : DIC(a, c, e) 및 위상차(b, d, f) 이미지, 인간 협점막 상피세포(a, b), 쥐 신장 조직의 두꺼운 단면(c, d), 오벨리아 다발모양 고리모양 줄기 과피
출처 : 올림푸스 라이프사이언스
차등 간섭 대조(DIC) 현미경은 Nomarski 간섭 대조라고도 하며, 투명한 표본의 놀랍고 거의 3D와 같은 이미지를 생성하는 정교한 기술입니다. 샘플 내의 미묘한 굴절률 변화를 드러내는 데 탁월합니다.
DIC는 편광광과 일련의 광학 요소를 사용하여 표본을 통과하는 두 개의 약간 오프셋된 빛줄기를 생성합니다. 표본의 굴절률 변화로 인해 발생하는 이러한 광선 사이의 광로 길이의 차이는 이미지를 생성하는 간섭 패턴을 초래합니다.
DIC는 특히 살아있는 세포, 배아, 미생물과 같은 염색되지 않은 생물학적 표본을 연구하는 데 유용합니다. 이 기술은 투명하거나 반투명한 재료를 조사하는 재료 과학에서도 가치가 있습니다.
DIC 현미경은 굴절률 변화가 미묘하고 얇고 투명한 샘플에 가장 적합합니다. 조직 절편이나 색소 침착이 심한 것과 같이 두꺼운 표본의 경우 효과가 크게 떨어집니다. DIC에는 특수 광학 구성 요소가 필요하므로 현미경 시스템의 전체 비용이 증가합니다.
광시야 형광 현미경은 전체 샘플에 여기 광을 조사하여 형광으로 표시된 구조를 시각화하는 기본적인 기술입니다.
형광은 형광체가 특정 파장(여기)에서 빛을 흡수하고 더 긴 파장에서 빛을 방출할 때 발생합니다. 표적 분자를 시각화하기 위해 항체 또는 핵산 프로브와 같은 형광체 접합 프로브를 사용하여 관심 있는 구성 요소를 특별히 표시합니다. 그런 다음 샘플에 여기 빛을 비추고 방출된 형광을 대물 렌즈로 수집합니다. 필터는 여기 빛을 차단하면서 방출된 빛을 선택적으로 투과시켜 형광 구조가 어두운 배경에 밝게 나타나는 이미지를 생성합니다.
광시야 형광 현미경은 특정 단백질을 탐지하고 국소화하기 위한 면역 형광 염색을 위한 생물학 연구에서 널리 사용됩니다. 또한 유전자 발현 패턴을 연구하기 위한 현장 하이브리디제이션과 세포 구조와 역학을 시각화하기 위한 세포 이미징에 사용됩니다.
다재다능하지만, 광시야 형광 현미경은 여러 가지 한계가 있습니다. 초점 평면 위와 아래 영역에서 방출되는 빛은 배경 노이즈에 기여하여 특히 두꺼운 샘플에서 이미지 선명도와 대비를 감소시킵니다. 여기 광에 장시간 노출되면 감광성 샘플이 손상될 수 있습니다. 형광체 농도가 낮으면 형광 신호가 약해질 수 있습니다.
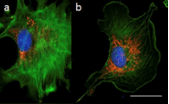
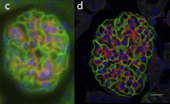
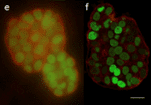
그림 7 : DAPI(핵 DNA-파란색), Alexa 3-팔로이딘(액틴 필라멘트 균주-녹색), MitoTracker Red(미토콘드리아-빨간색)로 표지된 상피 세포의 광시야 현미경(a, c, e)과 공초점 현미경(b, d, f)의 488D 이미지(a, b), DAPI(핵 DNA-파란색), Alexa 20-밀 배아 응집소(막 염색-녹색), Alexa 488-팔로이딘(액틴 필라멘트 염색-빨간색)으로 표지된 두께 약 568μm의 마우스 신장 절편(c, d), 핵 녹색 형광 단백질 융합과 막을 표시하는 빨간색 형광 단백질 융합으로 표지된 두께 약 3μm의 MCF-10A 유방 상피 세포 구형체의 50D 배양(e, f).
출처: doi: 10.7171/jbt.15-2602-003
공초점 현미경은 광시야 형광 현미경의 한계를 극복하여 이미지 해상도와 대비를 크게 향상시키는 강력한 기술입니다.
공초점 현미경은 레이저를 사용하여 샘플을 점별로 스캔합니다. 핀홀 조리개가 검출기 앞에 배치되어 초점 평면에서 방출되는 빛만 검출할 수 있습니다. 이렇게 하면 초점이 맞지 않는 빛을 효과적으로 제거하여 더 선명한 이미지를 얻을 수 있습니다.
공초점 현미경은 고해상도 이미징을 달성하기 위해 다양한 기술을 사용합니다.
공초점 현미경은 세포 구조, 단백질 국소화, 동적 프로세스를 연구하기 위해 생물학 및 생물의학 연구에 널리 사용됩니다. 광학적 단면을 만드는 능력 덕분에 조직 및 배아와 같은 두꺼운 표본을 이미징하는 데 특히 유용합니다.
공초점 현미경은 기존의 광시야 현미경에 비해 상당한 이점을 제공하지만 몇 가지 한계도 있습니다. 공초점 현미경의 포인트 스캐닝 특성으로 인해 특히 대규모 데이터 세트나 고해상도 이미징의 경우 이미지 획득이 느릴 수 있습니다. 공초점 현미경에 사용되는 강렬한 레이저 빛은 형광 샘플을 손상시키거나 표백시켜 관찰 시간을 제한하고 데이터 품질에 영향을 미칠 수 있습니다. 공초점 현미경은 구매 및 유지 관리 비용이 많이 들고 특수 장비와 숙련된 인력이 필요합니다.
팔로이딘, 핵 DNA, 세포막, 미토콘드리아 등을 포함한 Atlantis Bioscience의 다양한 세포 염색제를 살펴보세요!
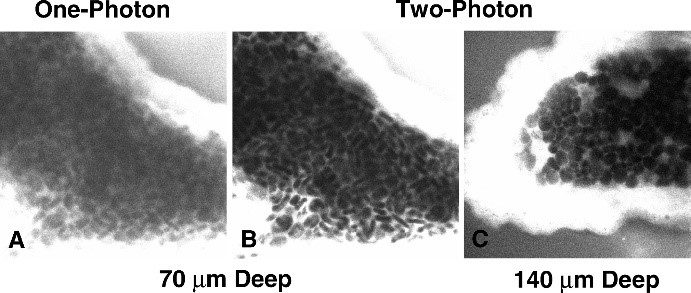
그림 7 : 공초점 현미경과 2광자 여기 현미경의 비교. (오른쪽) 플루오레세인으로 염색한 상어 맥락막 신경총의 이미지. 공초점 영상(A)의 대비는 70µm에서 상당히 저하되지만, 140광자 여기를 통해 XNUMXµm에서도 우수한 강도 대비를 갖는 영상을 수집할 수 있습니다. (왼쪽)
출처: doi: 10.1371 / journal.pbio.0030207
다중광자 현미경 또는 2광자 현미경은 전통적인 공초점 현미경의 기능을 뛰어넘는 고급 이미징 기술입니다. 더 깊은 조직 침투와 감소된 광독성을 허용하여 생물계를 연구하는 데 매우 귀중한 도구입니다.
형광체를 여기시키기 위해 단일 광자를 사용하는 대신, 다중 광자 현미경은 형광체를 동시에 공격하여 더 높은 에너지의 단일 광자를 방출하게 하는 두 개 이상의 광자를 사용합니다. 여기 광은 적외선 스펙트럼에 있기 때문에 공초점 현미경에서 사용되는 가시광선에 비해 조직에 더 깊이 침투하여 더 두꺼운 샘플의 이미징이 가능합니다. 여기 광의 에너지가 낮기 때문에 샘플의 광 손상 위험이 상당히 줄어듭니다.
다중광자 현미경은 고유한 특성으로 인해 두껍고 살아있는 표본을 이미징하는 데 탁월합니다. 조직 깊숙이 침투할 수 있는 능력으로 인해 뇌 구조, 배아 발달 및 장기 생리학을 비침습적으로 이미징하는 데 적합합니다. 광독성이 낮아 심각한 손상을 일으키지 않고 살아있는 세포 이미징과 동적 세포 과정의 장기 관찰이 가능합니다. 또한 생체내에서 질병의 동물 모델과 같은 손상되지 않은 생물체의 생물학적 과정을 연구하기 위한 이미징.
고출력 펨토초 레이저와 민감한 검출기를 포함한 필요한 특수 장비로 인해 다중 광자 현미경은 비용이 많이 드는 기술입니다. 공초점 현미경보다 깊지만 침투 깊이는 여전히 조직 내에서의 빛 산란과 흡수에 의해 제한됩니다. 모든 형광체가 2광자 여기를 위해 효율적인 것은 아니므로 표지제 선택이 제한됩니다.
2광자 이미징을 위한 팔로이딘 염색을 찾고 계신가요? 초고해상도 및 2광자 이미징을 위한 염색 옵션이 있는 팔로이딘 접합체를 살펴보세요
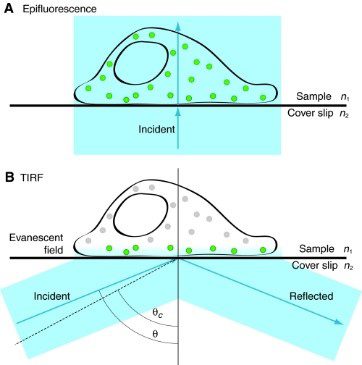
그림 8 : 에피플루오레센스와 TIRF 조명의 물리적 기초(A, B).
에피플루오레슨과 TIRF를 이용하여 얻은 이미지 비교 (C, D)
출처 doi: 10.1242/jcs.056218
TIRF 현미경은 세포 표면 근처에서 발생하는 영상화 과정에 뛰어난 감도와 공간 분해능을 제공하는 특수 형광 기술입니다.
빛이 굴절률이 다른 두 매질(예: 유리와 물) 사이의 계면에서 전반사될 때 소멸파가 생성됩니다. 이 파동은 짧은 거리(일반적으로 100-200nm)를 두 번째 매질로 침투합니다. 소멸장 내의 형광체만 여기되어 벌크 용액의 배경 형광이 최소화됩니다. 이로 인해 신호 대 잡음비가 높아집니다.
TIRF는 수용체-리간드 상호작용, 소포와 단백질의 이동, 세포내입, 바이러스 감염, 세포 표면에서의 세포-기질 상호작용 또는 세포골격 역학과 같은 막 역학을 시각화하는 데 매우 유용합니다.
TIRF 현미경의 단점은 부착 배양 세포를 사용해야 하므로 현탁 세포나 특정 유형의 조직에 대한 사용이 제한된다는 것입니다.
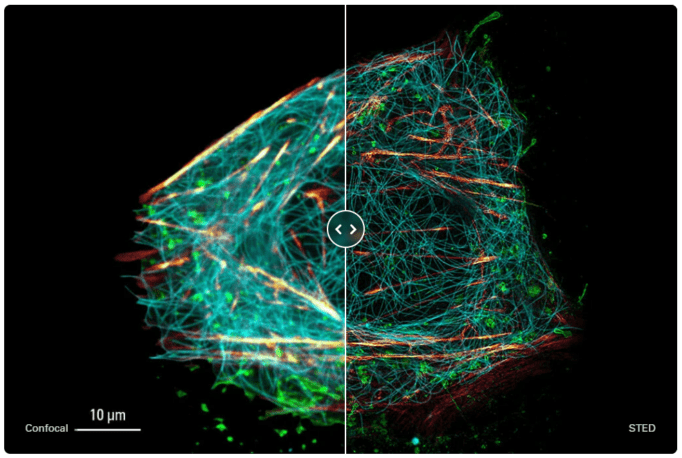
그림 9 : U2OS 세포의 생세포 TauSTED 이미지. 액틴(SiR-액틴, 빛), 미세소관(SPY555-튜불린, 청록색) 및 막(WGA에 결합된 CF488A, 녹색)에 대한 라벨을 사용함.
출처: 라이카 마이크로 시스템즈
초고해상도 현미경은 전통적으로 광학 현미경의 분해능을 제한하는 회절 한계를 뛰어넘는 기술의 모음입니다. 이 획기적인 분야는 세포 및 분자 과정에 대한 우리의 이해에 혁명을 일으켰습니다.
회절 한계는 빛의 파동적 특성에 의해 부과되는 물리적 제약으로, 기존 광학 현미경의 분해능을 약 200nm로 제한합니다. 초고해상도 기술은 이러한 제한을 우회하기 위해 다양한 전략을 사용하여 나노스케일(5-20nm)에서 이미징을 가능하게 합니다. 일반적으로 초고해상도 기술은 샘플 내의 형광체의 정확한 위치와 여러 프레임 또는 측정의 정보를 결합하여 고해상도 이미지를 만드는 계산 재구성을 포함합니다. 이러한 기술은 형광체의 방출 특성을 조작하거나 구조화된 조명을 사용하여 빛의 파장에 의해 부과되는 제한을 우회합니다.
각각 고유한 접근 방식을 갖춘 여러 가지 초고해상도 기술이 개발되었습니다.
초고해상도 현미경은 나노스케일에서 광범위한 분야에 적용되었습니다. 여기에는 세포 구조의 조직과 분자 상호작용의 역학 연구, 시냅스와 신경망의 미세 구조 이미징, 나노물질과 그 특성 특성화, 질병의 분자적 기초 조사가 포함됩니다.
초고해상도 현미경은 전례 없는 세부 정보를 제공하지만 여러 가지 과제에 직면합니다. 해상도가 높아짐에 따라 기술적 요구와 한계가 더욱 두드러집니다. 여기에는 특수 형광체에 대한 필요성, 진동과 같은 환경 요인에 대한 민감성, 광독성 가능성이 포함됩니다. 또한 초고해상도 시스템은 복잡하고 비용이 많이 들며, 종종 장비와 전문 지식에 상당한 투자가 필요합니다. 샘플 무결성 및 비용 효율성과 같은 실용적인 고려 사항과 더 높은 해상도에 대한 욕구의 균형을 맞추는 것이 성공적인 초고해상도 이미징에 필수적입니다.
초고해상도 현미경을 위한 검증된 CF® 염색제와 세포 염색제를 확인해 보세요.
참조 :
Bhakdi SC, Thaicharoen P. 광시야 형광 현미경에서 7개 형광체의 쉬운 사용 및 교차간섭 없는 검출. 방법 프로토콜. 2018;1(2):20. 2018년 1월 10.3390일 출판. doi:1020020/mpsXNUMX
Jonkman J, Brown CM. Any Way You Slice It-공초점 현미경 기술 비교. J Biomol Tech. 2015년 26월;2(54):65-10.7171. doi: 15/jbt.2602-003-25802490. PMID: 4365987; PMCID: PMCXNUMX.
Mattheyses AL, Simon SM, Rappoport JZ. 세포 생물학자를 위한 전반사 형광 현미경으로 이미징. J 세포 과학. 2010;123(Pt 21):3621-3628. doi:10.1242/jcs.056218
피스톤 DW. 두 개가 한 개보다 나을 때: 생체 현미경의 요소. PLoS Biol. 2005;3(6):e207. doi:10.1371/journal.pbio.0030207
https://www.sciencelearn.org.nz/images/526-resolving-power-of-microscopes
https://www.aps.org/apsnews/2004/03/lens-crafters-1590-invention-microscope
https://www.microscopeclub.com/bright-field-microscope
https://www.microscopeclub.com/dark-field-microscopy
https://www.microscopyu.com/techniques/phase-contrast/introduction-to-phase-contrast-microscopy
https://www.olympus-lifescience.com/en/microscope-resource/primer/techniques/dic/dicphasecomparison
https://ibidi.com/content/215-widefield-fluorescence
https://www.leica-microsystems.com/science-lab/super-resolution-microscopy-image-gallery

암 연구에 활력을 불어넣는 5가지 획기적인 세포 염색을 발견해보세요! 이러한 혁신이 어떻게 새로운 목표를 밝히고 맞춤형 의약품을 추진하는지 알아보세요.
Sudan Black B는 전통적으로 리포푸신 자가형광을 끄는 데 사용되었습니다. 그러나 비특정 배경을 소개한다. TrueBlack®은 신경과학 연구에서 일반적으로 사용되는 대안입니다.

고객 관리, 영업 및 과학 지원에 문의하세요.

당사 제품 및 서비스에 대한 상담 및 질문

기술 및 안전 데이터 시트, 가이드 등의 문서...