ActSep®CD3/CD28 분리 및 활성화 자기 비드
- FDA DMF 신청: 038124
- 높은 안정성과 안전성, 낮은 내독소.
- 4.5um 초상자성 비드, 인공 항원 제시 입자.
- 세포 분리 및 활성화 효율이 높습니다. 자석 비드의 제거가 용이하고 조작이 용이합니다.
여행지 설명
ActSep®CD3/CD28 분리 및 활성화 마그네틱 비드는 인간 CD3+T 세포 분리에 적합하며, 항원 제시 세포 및 항원이 필요 없이 인간 T 세포를 활성화하고 확장하는 간단한 방법을 제공합니다. 자기 비드에 항인간 CD3 및 항인간 CD28 항체를 결합함으로써 T 세포 활성화 및 확장을 조절하는 데 필요한 XNUMX차 및 공동 자극 신호가 제공됩니다. 비드는 인간 T 세포 분리, 활성화 및 확장, CAR-T 및 기타 T 세포 배양 응용 분야에 적합합니다.
카탈로그 번호 : GMP-TL603
내용량 : 1mL
농도 : 2×108구슬/mL
엔도톡신 : <0.5 EU/mL
반응종 : 인간
유효기간 : 24개월
보관온도 : 2~8C
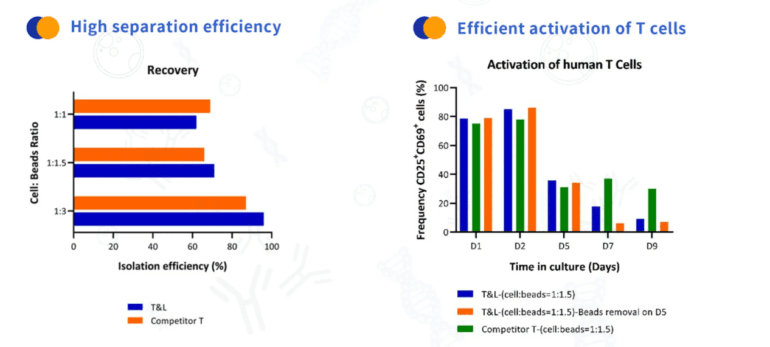
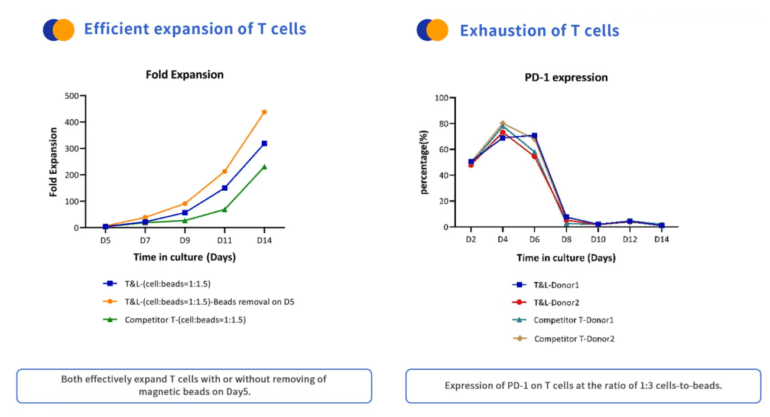
제품 성능
프로토콜
1. PBMC 세포 처리:
1.1 1% HSA가 포함된 PBS 완충액에 인간 PBMC 세포를 재현탁하고 유세포 분석을 통해 샘플 내 CD3+ T 세포의 비율을 결정합니다.
1.2 PBMC 세포의 CD3 양성률에 따라 3% HSA가 포함된 PBS 완충액을 사용하여 CD1+ T 세포의 밀도를 107×1 세포/mL로 조정합니다.
2. ActSep® CD3/CD28 분리 및 활성화 자기 비드 세척:
2.1 자기 비드를 다시 매달아 놓습니다(30초 이상 소용돌이치거나 5분 동안 기울이고 회전).
2.2 자성 비드 및 CD3+ T 세포의 수에 따라 권장되는 비드:T 세포 비율은 1:1 ~ 3:1입니다. (이 간격에서 자성 비드의 양이 증가함에 따라 세포 분리 효율이 향상됩니다. 실제 적용에서는 고객이 실제 상황에 따라 비율을 조정할 수 있습니다. 일정량의 자성구슬을 원심분리관에 옮깁니다.
2.3 1% HSA가 포함된 PBS 완충액 1mL를 추가한 후 재현탁하고 와류시킵니다.
2.4 튜브를 자석 위에 1분간 올려놓고 상층액을 버립니다. 자성구슬을 흡입하지 않도록 주의하세요.
3. CD3 + T 세포의 분리 및 활성화:
3.1 위에서 세척한 자성 비드에 PBMC 조정된 CD3+ T 세포 밀도를 비율에 맞게 첨가하고 잘 섞습니다.
3.2 위의 원심분리 튜브를 회전 속도 15~30rpm의 시료 혼합기에 놓고 실온에서 30분간 배양합니다.
3.3 위의 원심분리용 튜브를 자석 위에 1분간 올려놓고 상등액을 채취한다. 유세포 분석을 위해 세포 수를 세고 항CD3 항체로 염색하여 간접적인 방법으로 분리 효율을 계산합니다.
3.4 자성 비드와 세포의 혼합물을 200 IU/mL rh IL-2가 포함된 완전 배지로 재현탁합니다(고객은 실제 실험 조건에 따라 조정할 수 있으며 실험 필요에 따라 자가 혈장 사용 여부를 결정할 수 있음). 세포 밀도를 0.8~1.5×106/mL.T로
3.5 배양 용기를 세포 배양 용기에 넣고 37°C, 5% CO2에서 48시간 동안 배양합니다. 샘플을 채취하여 자성 비드 제거 후 활성화 효율을 계산하고 테스트합니다(CD69+CD25+ 백분율).
4. 세포 증식 및 배양: 세포 상태를 관찰하고 정기적으로 증식 배지를 보충하십시오. T 세포 밀도가 > 2.5 × 106 세포/mL이거나 배지가 노란색으로 변하면 세포를 약 0.5~1×106 T 세포/mL로 희석합니다. 세포는 적절한 기간(보통 12~14일) 동안 배양한 후 수확할 수 있습니다.
주의:
1. 세포 확장 후, 배양 용기의 세포 현탁액을 주기적으로 가볍게 불어서 자성 비드와 세포가 적절하게 분산되도록 해야 합니다.
2. 배양 과정에서 2~3일 간격으로 세포수를 측정할 수 있으며, 세포수 측정 전 자석 비드를 제거해야 합니다. 자성 비드 제거 과정: 배양 용기 내의 세포를 균일하게 현탁하여 원심분리용 튜브에 샘플링하고, 자석 위에 놓고 1분간 방치한 후 상등액을 새로운 원심분리용 튜브에 옮겼습니다.
3. T 세포는 적당한 기간 동안 배양한 후 자성 비드를 제거한 후 수확하였습니다.
4. T 세포의 순도, 표현형 및 활성화 상태는 세포 배양 중 유동 세포 계측법으로 감지할 수 있습니다.
참고 출판물
Pan, J., Tan, Y., Wang, G., Deng, B., Ling, Z., Song, W., Seery, S., Zhang, Y., Peng, S., Xu, J., Duan, J., Wang, Z., Yu, X., Zheng, Q., Xu, X., Yuan, Y., Yan, F., Tian, Z., Tang, K., Zhang, J., … 펑, X.
T 세포 급성 림프구성 백혈병을 위한 기증자 유래 CD7 키메라 항원 수용체 T 세포: 인간 최초, XNUMX상 시험.
임상종양학회지 : 미국임상종양학회 공식저널 vol. 39,30 (2021) : 3340-3351. doi:10.1200/JCO.21.00389